Un trabajo publicado en la revista Protein Science por el grupo de la Dra. Susana Camarero en el Centro de Investigaciones Biológicas Margarita Salas (CIB-CSIC), presenta por primera vez la estructura cristalina de una subunidad pequeña que forma un heterodímero con la enzima tipo lacasa (NLAC) del hongo Pleurotus eryngii. El trabajo, en colaboración con el Dr. Javier Medrano también en el CIB-CSIC, describe las características estructurales de la NLAC implicadas en la interacción que estarían relacionadas con el diferente comportamiento de la NLAC en su forma monomérica o heterodimérica, así como en comparación con una lacasa canónica.
Las lacasas fúngicas son oxidasas multicobre monoméricas de gran interés biotecnológico debido a su capacidad para oxidar lignina y una serie de compuestos aromáticos. Las NLAC son enzimas similares a las lacasas, poco caracterizadas, que forman heterodímeros con pequeñas proteínas (subunidades) de función desconocida.
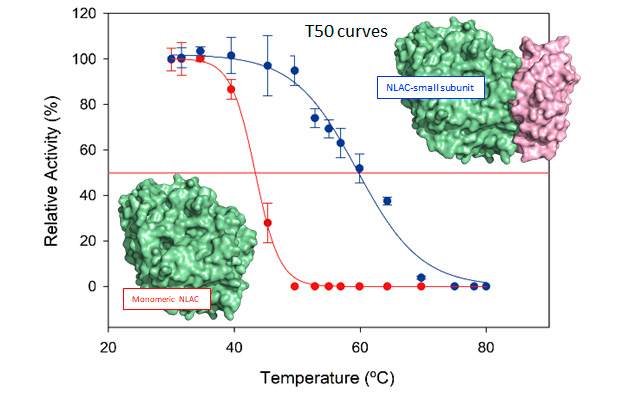
Aza et al. han producido heterólogamente y caracterizado la NLAC del hongo Pleurotus eryngii. La enzima forma un heterodímero con una pequeña proteína que se encuentra en el genoma fúngico y que fue co-clonada con la enzima en Aspergillus oryzae o añadida a la enzima de forma exógena. El heterodímero muestra una notable estabilidad mejorada frente a la temperatura, el pH ácido y la presencia de cosolventes, y una actividad superior en comparación con la enzima sola.
En este trabajo, los autores presentan la primera estructura cristalina de una subunidad pequeña de un NLAC que aporta pruebas sobre las interacciones con la subunidad catalítica en el heterodímero. La estructura cristalográfica de la pequeña proteína expresada en Escherichia coli se resolvió a 1,6 Å de resolución y permite describir características estructurales distintivas de la NLAC que probablemente estén implicadas en la interacción con la estructura en haz de hélices de la subunidad pequeña y/o en la unión a sustrato, lo que modularía la actividad enzimática y explicaría las diferencias en actividad y estabilidad de la enzima monomérica o en el complejo, y la actividad de la NLAC comparada con una lacasa canónica.
Los resultados obtenidos arrojan luz sobre la estructura-función de estas lacasas no canónicas poco caracterizadas y sobre el papel de las subunidades pequeñas en los heterodímeros formados.
Referencia: Role and structure of the small subunit forming heterodimers with laccase-like enzymes. Pablo Aza, Dolores Linde, Gonzalo Molpeceres, Jesper Vind, F. Javier Medrano and Susana Camarero (2023) Protein Science. https://doi.org/10.1002/pro.4734

