Las bacterias patógenas del grupo Firmicutes, como estafilococos, estreptococos y enterococos causan enfermedades infecciosas que presentan altas tasas de morbilidad y mortalidad. Además, son reserva de genes que se movilizan entre ellas mediante procesos de transferencia genética horizontal, lo que conduce a la dispersión de resistencias a antibióticos.
Ahora, grupos de investigación del instituto para la Investigación en Biomedicina (IBR-Barcelona) y del Centro de Investigaciones Biológicas han resuelto la estructura tridimensional de la relaxasa MobM, proteína codificada por el plásmido promiscuo pMV158, que es clave en el proceso de la transferencia de resistencias a antibióticos.
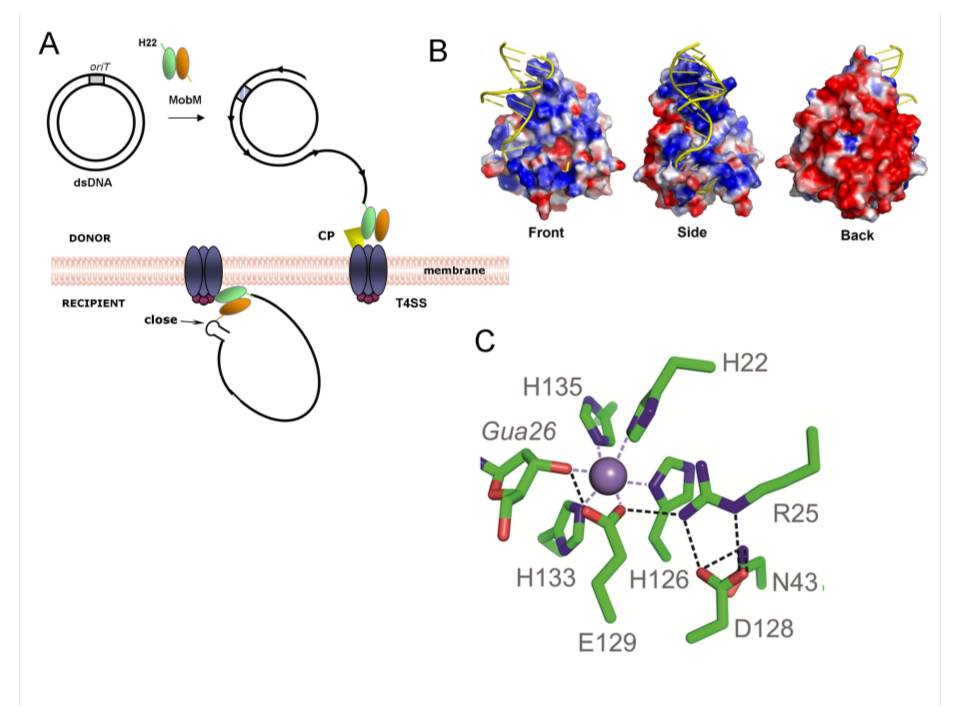
MobM es responsable de la iniciación y terminación de la movilización conjugativa de plásmidos entre bacterias. La transferencia de DNA implica el contacto físico entre una bacteria donadora y otra receptora de la misma o de diferente especie. La transferencia está mediada por proteínas denominadas relaxasas, que reconocen un sitio determinado en su DNA diana y producen un corte específico en la cadena de DNA que es transferida. El complejo MobM-DNA se transfiere a continuación de la bacteria donadora a la receptora mediante un complejo multiproteico denominado Sistema de Secreción de Tipo IV.
El trabajo publicado en PNAS y que cuenta con la participación del grupo del Dr. Manuel Espinosa proporciona la estructura tridimensional de seis complejos formados por la proteína MobM y variantes de su DNA diana, que muestran como el DNA se une a regiones de la proteína que tienen carga electropositiva. En todas las relaxasas descritas previamente, la reacción de escisión estaba mediada por un residuo de tirosina. Los análisis del centro activo de la proteína en los complejos que se caracterizan en este estudio revelaron la presencia de un ión de manganeso y que, inesperadamente, es el residuo de Histidina en posición 22 el que realiza el ataque al DNA substrato.
Estos resultados se confirmaron mediante análisis computacionales, bioquímicos y funcionales y constituyen un nuevo mecanismo para relajar DNA plasmídico en la conjugación abriendo nuevos caminos para el desarrollo de herramientas que reduzcan la frecuencia de la transmisión genética horizontal.
Referencia: Structural basis of a novel histidine-DNA nicking/joining mechanism for gene transfer and promiscuous spread of antibiotic resistance. Radoslaw Pluta, D. Roeland Boer, Fabián Lorenzo-Díaz, Silvia Russi, Hansel Gómez, Cris Fernández-López, Rosa Pérez-Luque, Modesto Orozco, Manuel Espinosa and Miquel Coll. PNAS (2017). doi: 10.1073/pnas.1702971114.

