La visión ampliamente aceptada en el campo del transporte intracelular entre compartimentos membranosos es que las vesículas entrantes son reclutadas a cierta distancia de la membrana de destino por ‘tentáculos’ moleculares, tras lo cual un conjunto de proteínas denotadas SNAREs se cierran en cremallera formando un haz tetra-helicoidal altamente estable que proporciona la energía necesaria para la fusión de las membranas donadora y aceptora. La especificidad combinatoria de las SNARE mejora aún más gracias a ciertas proteínas que actúan como molde para la formación del haz. En los complejos de reclutamiento multisubunidad, las actividades de captura y molde residen en subunidades polipeptídicas diferentes.
En un trabajo publicado recientemente en la revista eLife, dirigido por Miguel Peñalva en el Laboratorio de Biología Celular de Aspergillus que el Dr. E.A. Espeso y él codirigen en el Centro de Investigaciones Biológicas Margarita Salas (CSIC), el Dr. Ignacio Bravo-Plaza et al. reportan evidencia de que una proteína denominada Uso1p (p115 en mamíferos) combina las actividades de ‘tentáculo’ y de regulación de SNARE en la misma cadena polipeptídica.
La vía secretora es un conjunto de compartimentos membranosos que transportan proteínas sintetizadas en el RE a la membrana plasmática y al sistema endolisosomal tras su clasificación en el Golgi (la oficina de correos de la célula). Uso1p actúa en una de las primeras etapas: el transporte entre el RE y el Golgi. De hecho, Yusou significa transporte en japonés, y fueron japoneses los investigadores que descubrieron en la levadura Uso1p, una proteína que resultó ser esencial para el transporte a través de la vía secretora.
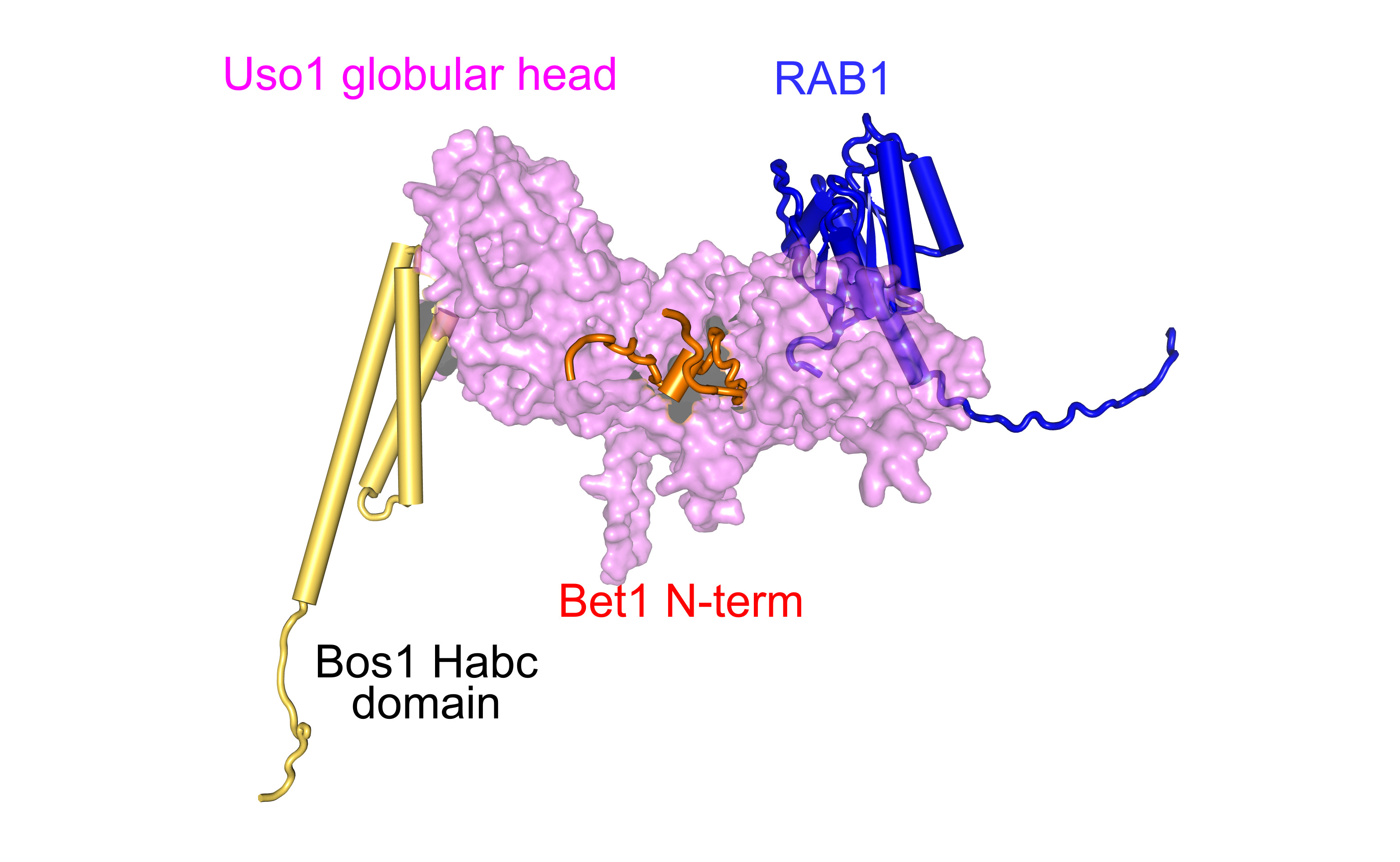
Uso1/p115 es una proteína de gran tamaño que RAB1 recluta a las membranas y que contiene una cabeza globular N-terminal y un dominio de coiled-coil C-terminal. La presencia de este último condujo al paradigma de que Uso1p actuaría como un ‘tentáculo’ que reclutaría vesículas COPII derivadas del RE al Golgi temprano. Sin embargo, este modelo no explicaba satisfactoriamente por qué otras proteínas que median el reclutamiento de vesículas al Golgi y que también contienen largos coiled-coils no son esenciales, lo que implica que Uso1p desempeña otro papel más allá de la simple captura de vesículas.
Ignacio-Bravo Plaza, recién doctorado por el Laboratorio de Biología Celular de Aspergillus, utilizó mutaciones generadas por genética clásica para tirar del hilo que les llevó a él y a sus colaboradores a la caracterización de contactos previamente inadvertidos entre el dominio globular de Uso1 y las SNARES. Llegó a la conclusión de que Uso1p tiene dos actividades que residen en la misma cadena polipeptídica: una, localizada en el dominio globular, que es esencial e implica la regulación de SNAREs, y una segunda, la actividad no esencial de captura que reside en el coiled-coil.
Futuros experimentos que aborden el mecanismo molecular de la regulación SNARE a nivel atómico deberían ayudar a comprender la gran especificidad con la que las vesículas derivadas del RE se dirigen al cis-Golgi, aun insuficientemente comprendida casi 7 décadas después de que el Premio Nobel George Palade describiera el retículo endoplásmico rugoso.
Reference: The Uso1 globular head interacts with SNAREs to maintain viability even in the absence of the coiled-coil domain. Ignacio Bravo-Plaza, Victor G Tagua, Herbert N Arst, Ana Alonso, Mario Pinar, Begoña Monterroso, Antonio Galindo, Miguel A Peñalva (2023) eLife. May 30, 2023. https://doi.org/10.7554/eLife.85079

