El grupo de investigación de la Dra. Mª Cristina Vega del CIB Margarita Salas ha determinado la estructura de un nuevo factor de virulencia de Leptospira interrogans, la bacteria responsable de la leptospirosis, la enfermedad zoonótica más extendida. Este trabajo, publicado en Frontiers in Immunology en colaboración con el grupo del Dr. Santiago Rodríguez de Córdoba, permite profundizar en los mecanismos de inmunoevasión de Leptospira a través de la inhibición de las vías de señalización y reclutamiento de neutrófilos de la anafilotoxina C5a durante el proceso infeccioso.
La leptospirosis es una enfermedad zoonótica desatendida causada por la espiroqueta Gram-negativa Leptospira. Esta bacteria coloniza humanos, animales domésticos y de granja y especies salvajes como ratones, ratas y murciélagos, que sirven como reservorios de infección. En casi la totalidad del millón de casos de leptospirosis que se detectan cada año en seres humanos la enfermedad causa síntomas leves a severos que pueden resultar en fatalidad. El cambio climático, además, está acelerando la dispersión del patógeno y aumentando el número de casos anuales de leptospirosis.
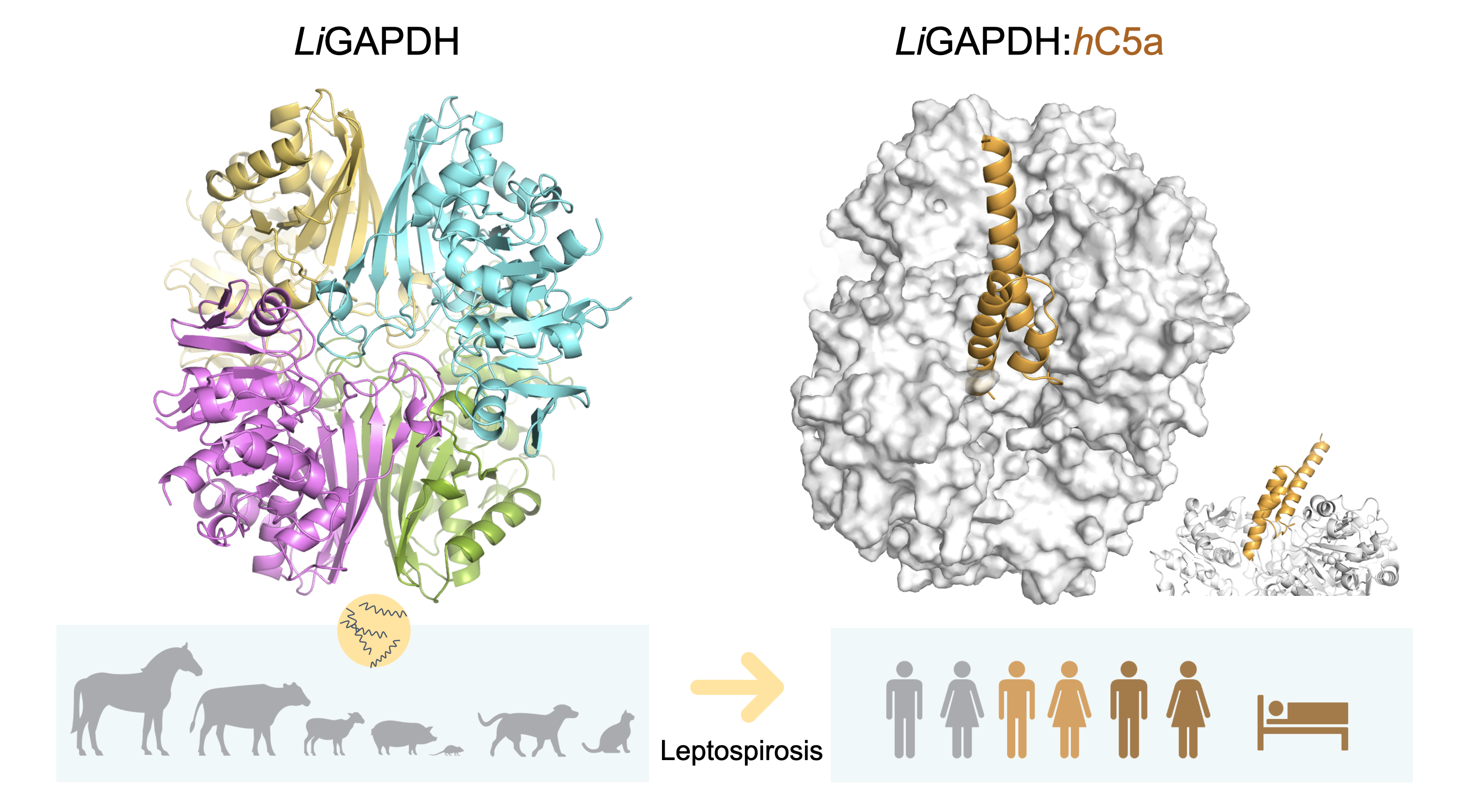
Leptospira despliega múltiples factores implicados en mecanismos de defensa durante el proceso infeccioso, a los que este trabajo suma una enzima glicolítica con funciones de pluriempleo, la gliceraldehído-3-fosfato deshidrogenasa (GAPDH). GAPDH es una de las proteínas más abundantes del proteoma extracelular de Leptospira, donde puede actuar como un factor de virulencia y potenciar la infectividad y la evasión del sistema inmune.
La estructura de LiGAPDH por cristalografía de rayos-X a 2,37 Å permite contar con una descripción detallada de esta proteína clave en procesos fisiológicos y patológicos, y ayuda a comprender su papel inmunoevasor como factor de virulencia y sus posibles aplicaciones en biomedicina. En este estudio, además de la caracterización de los parámetros cinéticos de la enzima con los sustratos naturales, se ha establecido mediante cross-linking e interferometría de biocapa que LiGAPDH puede interactuar in vitro con la anafilotoxina C5a del sistema del complemento, en un modo de unión caracterizado por constantes de asociación y disociación lentas. Estudios de docking guiado por los resultados experimentales de cross-linking muestran que el haz de α-hélices característico de la estructura de la anafilotoxina, con el único residuo de cisteína libre, interacciona con la zona del centro activo de LiGAPDH responsable de la unión al sustrato gliceraldehído 3-fosfato (G3P) en el dominio N-terminal. El área enterrada por la interacción es ~3,000 Å2 y la naturaleza de la interacción es predominantemente polar, donde el haz de α-hélices de C5a presenta carga negativa y el centro activo de LiGAPDH carga positiva. Este modo de interacción es consistente con otros complejos de GAPDH con proteínas α-helicoidales. Dado que GAPDH es una proteína altamente conservada, el modelo de unión es extrapolable a muchos otros microorganismos patógenos en los que GAPDH actúa como factor de virulencia al secuestrar C5a.
Este trabajo añade L. interrogans a la creciente lista de patógenos bacterianos en los que enzimas glicolíticas como GAPDH actúan como factores de inmunoevasión. Los grupos de la Dra. Vega y el Dr. Rodríguez de Córdoba pertenecen a la Plataforma Salud Global del CSIC donde colaboran en estudios de procesos infecciosos e inflamatorios en los que C5a está implicado. En los últimos años, en colaboración con los grupos de José Ramón Regueiro de la UCM y Sebastián Albertí Serrano de la UIB, se ha establecido que el secuestro de la anafilotoxina C5a por GAPDH inhibe de manera significativa la quimioatracción de neutrófilos por C5a. De esta manera, patógenos como Atopobium vaginae o Streptococcus pyogenes, y ahora L. interrogans, merman la respuesta del sistema inmune innato y favorecen el proceso infeccioso.
Estos resultados se enmarcan en la Red de Investigación Temática del Complemento en Salud y Enfermedad (RED2022-134750-T) y han sido financiados por el Consorcio de Biomedicina de la Comunidad de Madrid Complemento III-CM (P2022/BMD-7278).
Referencia: The structure of Leptospira interrogans GAPDH sheds light into an immunoevasion factor that can target the anaphylatoxin C5a of innate immunity. Navas-Yuste S, de la Paz K, Querol-García J, Gómez S, Rodríguez de Córdoba S, Fernández FJ, Vega MC [2023]. Front Immunology 14:1190943. https://doi.org/10.3389/fimmu.2023.1190943
Más información:
- Gómez S, Querol-García J, Sánchez-Barrón G, Subías M, González-Alsina A, Franco-Hidalgo V, Albertí S, Rodríguez de Córdoba S, Fernández FJ, Vega MC [2019]. Front Microbiol. 10:326. https://www.frontiersin.org/articles/10.3389/fmicb.2019.00326/full
- Fernández FJ, Gómez S, Vega MC [2019]. Seminars Cell Dev Biol. 85, 98-109. https://www.sciencedirect.com/science/article/abs/pii/S1084952117301386?via%3Dihub
- Querol-García J, Fernández FJ, Marin AV, Gómez S, Fullà D, Melchor-Tafur C, Franco-Hidalgo V, Albertí S, Juanhuix J, Rodríguez de Córdoba S, Regueiro JR, Vega MC. [2017]. Front Microbiol 8:541. https://www.frontiersin.org/articles/10.3389/fmicb.2017.00541/full

