Investigadores del Centro de Investigaciones Biológicas Margarita Salas (CIB-CSIC), junto con investigadores de la Universitat de València-ERI Biotecmed y el CIBER de enfermedades raras CIBERERE-ISCIII, han elucidado la estructura de la proteína insecticida Vip3A, así como los cambios que sufre para pasar de su conformación inactiva (“protoxina”) a su conformación activa (“toxina”). Los resultados de este trabajo, liderado por el Dr. Ernesto Arias, han sido publicados en la revista Nature Communications.
Vip3A es una proteína insecticida secretada por la bacteria Bacillus thuringiensis que presenta una potente acción frente a un amplio espectro de lepidópteros. Hoy en día se utiliza, tanto en cultivos ecológicos y convencionales en biopesticidas de pulverización (insecticidas Bt), como en cultivos transgénicos protegidos contra el ataque de insectos (cultivos Bt). Sin embargo, se desconocía el mecanismo por el que Vip3A inducía su acción insecticida.
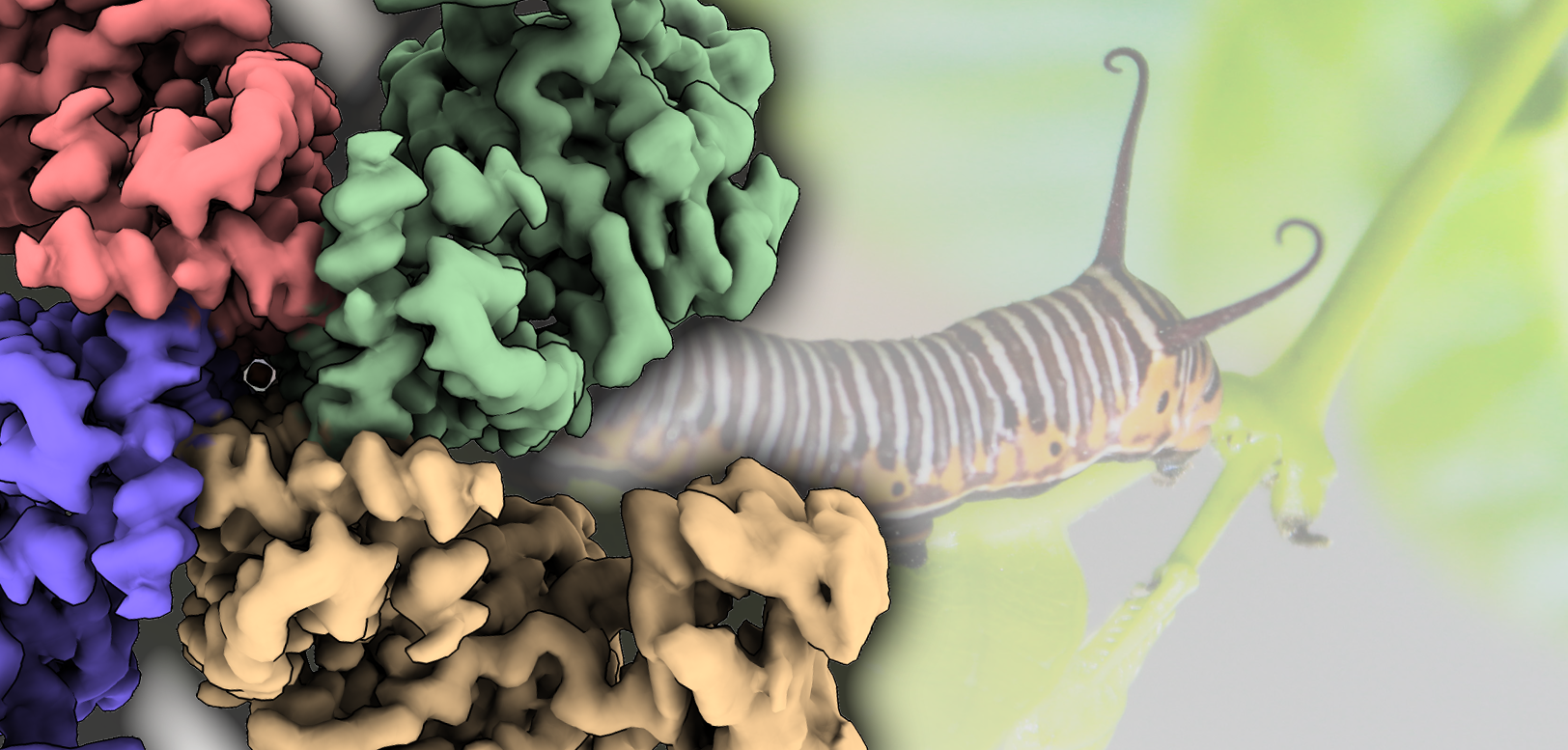
Estas proteínas se producen como protoxinas inactivas que necesitan ser activadas por las proteasas del intestino medio para desencadenar la muerte celular. Sin embargo, la comprensión sobre su organización tridimensional y mecanismo de activación a nivel molecular era hasta este momento muy limitada. Nuñez-Ramírez et al. han determinado las estructuras de la protoxina y el estado activado por proteasa de Vip3Aa a 2,9 Å mediante microscopía crioelectrónica. Las reconstrucciones muestran que la protoxina se ensambla en un tetrámero de aaspecto piramidal con los dominios C-terminales expuestos al disolvente y la región N-terminal doblada en un ápice cargado por resorte. El dominio C-terminal presenta un sitio de corte que es reconocido por las proteasas del sistema digestivo del insecto, cuya acción producirá un corte que facilitará la conversión de la protoxina en toxina. Después de la activación de la proteasa, se produce una remodelación dramática de la región N-terminal de la proteína que da como resultado la formación de un entrelazado (“coiled-coil”) paralelo de cuatro hélices con aspecto de aguja. Curiosamente, esta aguja de casi 160 Å es lo suficientemente larga como para alcanzar y perforar la membrana de la célula del insecto y producir su efecto tóxico.
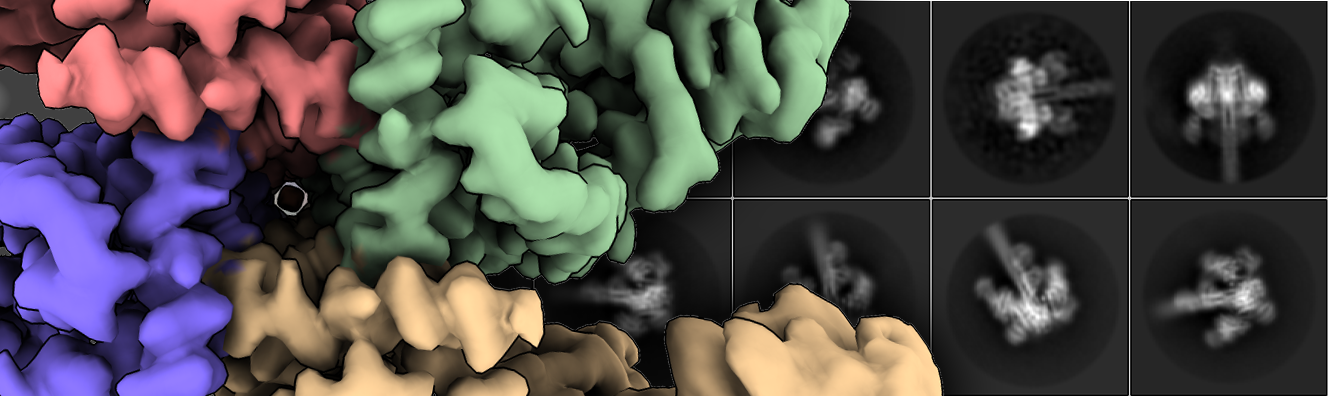
En conjunto, este trabajo desvela los cambios estructurales que conducen de la conformación de protoxina a la forma activa de las proteínas de la familia Vip3, mecanismos desconocidos hasta ahora a pesar de que están proteínas se llevan estudiando desde hace décadas. Los estudios realizados ayudan a comprender cómo las proteínas Vip3 destruyen las células epiteliales del intestino medio de las larvas de los insectos, y conducen finalmente a su muerte.
Adicionalmente, estos resultados son un punto de inflexión en el estudio de la acción insecticida de Vip3A y abren la puerta al desarrollo de nuevas aplicaciones biotecnológicas que permitan producir proteínas insecticidas más estables y con mayor actividad para el control de plagas en agricultura.
Referencia: Molecular architecture and activation of the insecticidal protein Vip3Aa from Bacillus thuringiensis. Rafael Núñez-Ramírez, Juanjo Huesa, Yolanda Bel, Juan Ferré, Patricia Casino, Ernesto Arias-Palomo (2020) Nature Comm. 11, 3974 (2020). https://doi.org/10.1038/s41467-020-17758-5

