Responsable/s del laboratorio
intro
Desde el descubrimiento, por von Behring y Kitasato en 1890, de la presencia de anticuerpos específicos frente al agente causal del tétanos, una vez superada la fase aguda de la enfermedad, y que estos anticuerpos evitaban nuevas infecciones, se han buscado activamente este tipo de efectos para prevenir las enfermedades infecciosas.
La acción de anticuerpos específicos frente a bacterias y virus principalmente, provocó un descenso drástico en las epidemias de enfermedades como la difteria, la tos ferina, el tétanos, la poliomielitis, etc, que habían constituido un auténtico problema para la salud pública en todo el mundo a lo largo de la historia. Los microorganismos inactivados o los fragmentos purificados de los mismos, han constituido una fuente de antígenos que han permitido, a lo largo de más de un siglo, mejorar la protección frente a muchas enfermedades infecciosas tanto en el hombre como en los animales. El avance de la biología molecular ha permitido, en los últimos cuarenta años, la obtención de vacunas recombinantes eficaces. Además, ha permitido el estudio de los mecanismos de protección del sistema inmunitario del hospedador y su relación con la expresión génica de determinados genes.
El Laboratorio de Parasitología Molecular del Centro de Investigaciones Biológicas trabaja en el desarrollo de una vacuna frente a la infección por protozoos del género Leishmania en el modelo del perro.
La leishmaniasis es un conjunto de enfermedades parasitarias producidas por protozoos del género Leishmania, perteneciente a la familia de los tripanosomátidos. Según las manifestaciones clínicas, la leishmaniasis se clasifica en cutánea, mucocutánea y visceral, siendo ésta última mortal sin tratamiento, dependiendo de la respuesta inmunitaria del hospedador y de la especie de Leishmania. La leishmaniasis visceral, causada por L. infantum, es endémica en la cuenca mediterránea, donde el principal reservorio es el perro. La OMS estima una incidencia anual mundial de 2 millones de casos en 88 países tropicales y subtropicales, de los cuales 0,5 millones corresponden a la leishmaniasis visceral con una mortalidad de aproximadamente 60.000 personas. El estudio de los perfiles de expresión génica del agente infeccioso en los procesos de infección se utiliza para el desarrollo y la mejora de vacunas. Asimismo, se detectan los genes implicados en el mecanismo de infección/defensa entre el parásito y el hospedador.
Actualmente, son dos las líneas de investigación que se llevan a cabo en el laboratorio:
La línea de investigación I está basada en el estudio de los perfiles de expresión génica diferencial, mediante transcriptómica y proteómica, de los estadíos del ciclo biológico de Leishmania infantum en cultivo y en el hospedador intermediario. En estos estudios se ha profundizado en los procesos de diferenciación: el desarrollo de los promastigotes no infectivos a formas infectivas (metacíclicas) y el de la diferenciación de los promastigotes a amastigotes.
Inicialmente, se ha realizado la comparación de los transcriptomas de los diferentes estadíos mediante microarrays de ADN construidos en nuestro laboratorio a partir de una genoteca obtenida por fragmentación al azar que representa el genoma completo de L. infantum. Además de las diferencias de expresión génica detectadas entre los diferentes estadíos, se pudo observar que la sub-expresión predomina sobre la sobre-expresión en los amastigotes (Alcolea y cols., 2010). También se detectaron proteínas diferencialmente expresadas (Alcolea y cols., 2011). Actualmente, los análisis se están llevando a cabo mediante RNA-seq y iTRAQ.
Por otro lado, se separaron mediante selección negativa con aglutinina de cacahuete (PNA) la subpoblación PNA- (metacíclica) de la PNA+ (procíclica) y se compararon sendos transcriptomas (Figura 1) con la misma aproximación (Alcolea y cols., 2009). Como resultado, se detectó la sobre-expresión de genes relacionados directa e indirectamente con la infectividad; por ejemplo, la tirosina aminotransferasa está sobre-expresada en PNA- y ha sido caracterizada en nuestro laboratorio. La resolución de su estructura (Figura 2) (Moreno y cols., 2014a) en colaboración con el Prof. Peter J. Myler (SSCGID) ha permitido la caracterización de un farmacóforo (Moreno y cols., 2014b). La mayor infectividad de la subpoblación PNA- fue comprobada mediante ensayos de infección in vitro de la línea celular humana U937 (Alcolea y cols., 2009). Además, se ha llevado a cabo la caracterización completa de la ADN polimerasa β de L. infantum (Alonso y cols., 2006; Mejía y cols. 2014).
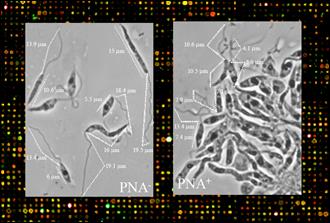
Figura 1. Cultivo axénico de promastigotes de Leishmania infantum aislados con PNA. El transcriptoma de los promastigotes menos infectivos (procíclicos, PNA+) y promastigotes más infectivos (metacíclicos, PNA-) fue comparado mediante microarrays de ADN.
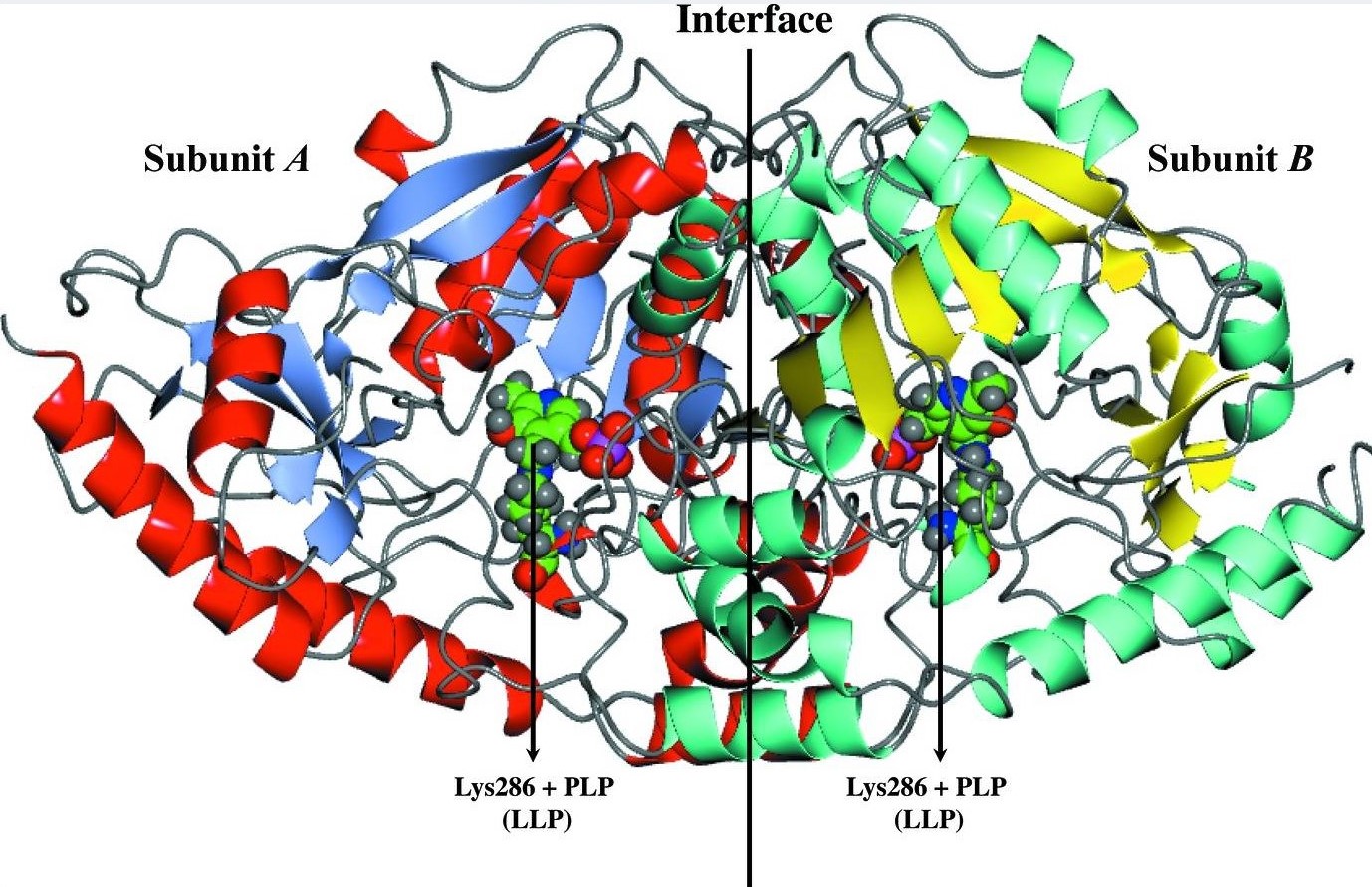
Figura 2. Estructura de la LiTAT.
En otro estudio realizado en el laboratorio, (Alcolea y cols., 2010), se describe la influencia del aumento de la temperatura y de la acidificación en el transcriptoma de forma aislada y combinada, que constituyen dos de los factores que intervienen en la diferenciación de los promastigotes a amastigotes. Este estudio ha permitido asociar directamente estos factores con la expresión diferencial de ciertos genes en los amastigotes frente a los promastigotes. Además, el agrupamiento o clustering jerárquico iterativo indica que la temperatura tiene mayor influencia que la acidificación en el proceso de diferenciación de los promastigotes a amastigotes.
El modelo de cultivo axénico se usa de forma generalizada para el estudio de la biología y la infectividad de los promastigotes. Esto es debido a la dificultad del aislamiento de promastigotes de su medio natural, el tubo digestivo del flebotomo, además del reducido número de promastigotes que se pueden obtener, lo que impide la realización de la mayor parte de los ensayos. Gracias a la colaboración del los Drs. Ricardo Molina y Maribel Jiménez (Unidad de Entomología Médica, Centro Nacional de Microbiología, Virología e Inmunología Sanitarias, Instituto de Salud Carlos III), se ha podido llevar a cabo la comparación transcriptómica de los promastigotes metacíclicos aislados del tubo digestivo con los metacíclicos aislados en cultivo y con amastigotes intracelulares (Alcolea y cols., 2014a; Alcolea y cols., 2016c; Alcolea y cols., 2016d) (Figuras 3 y 4). Además, la influencia de los nutrientes que aporta el suero que contiene los medios de cultivo de promastigotes ha sido estudiado (Alcolea y cols., 2016).
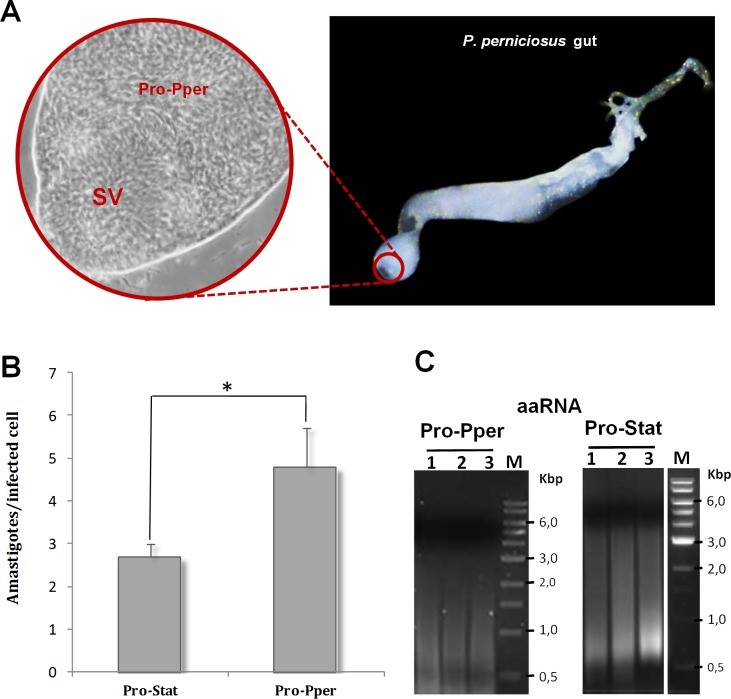
Figure 3. Dissection of the gut of a Phlebotomus perniciosus sand fly infected with Leishmania infantum promastigotes, in vitro infectivity and mRNA amplification.
(A) Detail of L. infantum promastigotes from the sand fly anterior midgut behind the SV (Pro-Pper) (40X) within the anterior thoracic midgut (10X). SV: stomodeal valve. (B) The U937 cell line was differentiated with phorbol esters on 8-well chamber slides and in vitro infected with Pro-Pper and axenic promastigotes in stationary phase (Pro-Stat). Approximately 5 x 104 promastigotes at a phagocyte:promastigote ratio 1:5 were added. The preparations were fixed and stained with modified Giemsa and 100 cells were randomly counted per replicate. The average number of amastigotes per infected cell was measured at 48 h post-infection. Mean ± SD: 2.7 ± 0.4 in the case of Pro-Stat and 4.8 ± 0.9 in the case of Pro-Pper. (C) Agarose gel electrophoresis of aaRNA samples used for the microarray analysis after synthesis of labeled cDNA. Total RNA was purified from isolated Pro-Pper immediately after dissection and doubly amplified (aaRNA) with MessageAmpII aRNA Amplification Kit (Life Technologies), due to sample amount requirements. Pro-Stat RNA was isolated and processed following the same procedure as for Pro-Pper.
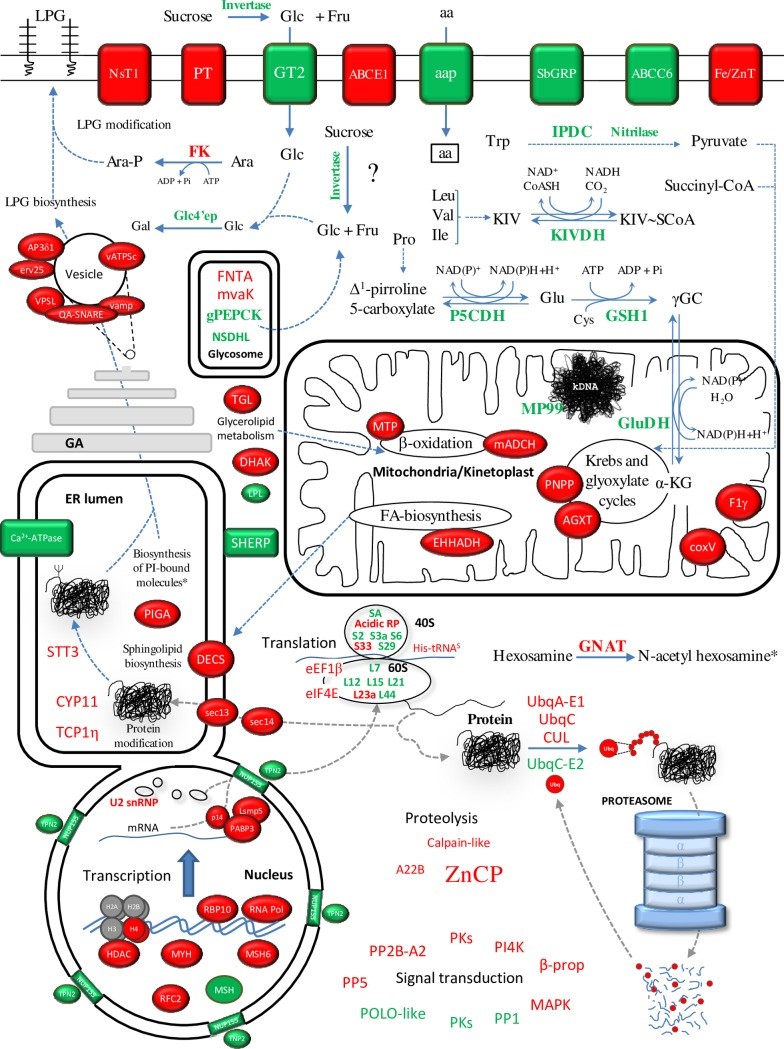
Figure 4. Differential gene expression in Pro-Pper vs. Pro-Stat. Up-regulated (red) and down-regulated (green) genes in Pro-Pper compared to Pro-Stat. Signal transduction pathways are unknown in trypanosomatids so far.
Otra estrategia que se está aplicando para la búsqueda de genes relacionados con la diferenciación y la infectividad de L. infantum es la aproximación comparativa con otras especies del género Leishmania y con Crithidia fasciculata, un tripanosomátido que está filogenéticamente muy relacionado pero cuyo ciclo biológico es monogenético, limitándose sólo a un hospedador díptero. Una primera aproximación se ha realizado mediante estudios de proteómica 2DE-MALDI-TOF/TOF y ha permitido diferenciar los patrones de expresión de los genes relacionados con la traducción y la homeostasis redox entre los estadíos móviles de ambos géneros (Alcolea y cols., 2014b). Actualmente, se está profundizando en esta comparación mediante RNAseq y iTRAQ incluyendo también el estadío amastigote de ambos parásitos en colaboración con el Prof. Peter J. Myler (Center for Infectious Disease Research, Seattle, WA, Estados Unidos).
Los resultados obtenidos en los diferentes estudios llevados a cabo en esta línea de investigación nos han permitido detectar un conjunto de genes que se sobre-expresan o sub-expresan en las distintas fases del desarrollo del parásito y su relación con la capacidad infectiva, así como la mayor importancia de la temperatura sobre el pH en el proceso de diferenciación de promastigote a amastigote.
Por otro lado, la otra línea de investigación llevada a cabo está basada en el estudio de la respuesta inmunitaria frente a la infección aplicada al desarrollo de vacunas en el modelo del perro (Línea de investigación II).
La mayor parte de los estudios realizados sobre la respuesta del sistema inmune frente a la infección por Leishmania se han llevado a cabo en el modelo de ratón. Éstos han permitido determinar que la respuesta inmune humoral no confiere protección y que la respuesta inmunitaria protectora es de tipo celular, en la cual están implicados principalmente los linfocitos T. La dicotomía observada en ratón entre la respuesta Th1, relacionada con la curación de la enfermedad y la respuesta Th2 relacionada con la susceptibilidad, no se produce en el modelo canino, sino que hay un balance entre ambas.
Nuestro laboratorio viene trabajando desde hace años en el desarrollo de una vacuna de ADN frente a la leishmaniasis canina. En primer lugar se desarrolló una vacuna basada en el gen del análogo del receptor de la proteína quinasa C activada (LACK) utilizando dos vehículos recombinantes para su administración, el vector plasmídico pCI-neo (pCI-neo-LACK) y el virus vaccinia (VV-LACK) en un régimen homólogo y heterólogo, obteniendo mejores niveles de protección con éste último. Posteriormente se introdujeron mejoras en el diseño de la vacuna, la utilización de un virus vaccinia no replicativo, el virus MVA y un plásmido sin resistencias a antibióticos como el plásmido pORT (Ramos y cols., 2008; Ramos y cols., 2009). Por otro lado, en colaboración con el laboratorio de la Dra. Rossi-Bergman del Instituto Carlos Chagas de Brasil, se llevó a cabo un estudio de protección en ratones con la utilización de la vacuna pCI-neo-LACK/pCI-neo-LACK vía intranasal obteniendo también buenos resultados de protección (Gomes y cols., 2007).
Con objeto de mejorar la protección conseguida con el gen LACK, se está desarrollando una nueva vacuna frente a la leishmaniosis canina que incluye nuevos genes candidatos. Para ello, en primer lugar se seleccionaron 40 genes de entre los diferencialmente expresados en los estudios mencionados anteriormente (Línea de investigación I) (Alcolea y cols., 2016e). A continuación, fueron clonados en un vector de expresión en Escherichia coli y se expresaron y purificaron las proteínas en condiciones desnaturalizantes, con las cuales se están llevando a cabo ensayos de protección frente a la infección por L. infantum en el modelo de ratón. Estos ensayos se están llevando a cabo con el Dr. Basilio Valladares (Universidad de la Laguna, Tenerife) y permitirán la selección de varios genes candidatos para incluirlos en la nueva vacuna multigénica.
Publicaciones seleccionadas
Dujardin JC, Herrera S, do Rosario V, Arevalo J, Boelaert M, Carrasco HJ, Correa-Oliveira R, García L, Gotuzzo E, Gyorkos TW, Kalergis AM, Kouri G, Larraga V [2010]. Research priorities for neglected infectious diseases in Latin America and the Caribbean Region. PLoS Negl Trop Dis 4(10):e780
Alcolea PJ, Alonso A, Gómez MJ, Moreno I, Domínguez M, Parro V, Larraga V [2010]. Transcriptomics throughout the life cycle of Leishmania infantum: high down-regulation rate in the amastigote stage. Int J Parasitol 40:1497-516
Alcolea PJ, Alonso A, Gómez MJ, Sánchez-Gorostiaga A, Moreno-Paz M, González-Pastor E, Toraño A, Parro V, Larraga V [2010]. Temperature increase prevails over acidification in gene expression modulation of amastigote differentiation in Leishmania infantum. BMC Genomics 14, 11:31
Ramos I, Alonso A, Peris A, Marcen JM, Abengozar MA, Alcolea PJ, Castillo JA, Larraga V [2009]. Antibiotic resistance free plasmid DNA expressing LACK protein leads towards a protective Th1 response against Leishmania infantum infection. Vaccine 27(48):6695-703
Alcolea PJ, Alonso A, Sánchez-Gorostiaga A, Moreno-Paz M, Gómez Manuel J, Ramos I, Parro V, Larraga V [2009]. Genome-wide analysis reveals increase levels of transcripts related with infectivity in peanut lectin non-agglutinated promastigotes of Leishmania infantum. Genomic 93: 551-564
García-Coiradas L, Angulo-Cubillas F, Méndez S, Larraga V, De la Fuente, C, Cuquerella M, Alunda JM [2009]. Isolation and immunolocalization of a putative protective antiigen (p26/23) from adult Haemonchus contortus. Parasitol Res 104(2) 363-9
Ramos, I, Alonso, A, Marcen,JM, Peris,A, Castillo, JA, Colmenares,M, Larraga,V. [2008]. Heterologous prime-boost vaccination with a non-replicative vaccinia recombinant vector expressing LACK confers protection against canine visceral leishmaniasis with a predominant Th1-specific immune response. Vaccine 17; 26(3):333-44.
Oliveira Gomez,DC, Fonseca Pinto, E, Barbosa de Melo,LD, Pacienza Lima,W, Larraga,V, Rossi-Bergman,B.( [2007]. Intranasal delivery of nacked DNA encoding the LACK antigen leads to protective immunity against visceral Leishmania in mice. Vaccine 25, 2168-2172
Alonso A, Terrados G, Picher AJ, Giraldo R, Blanco L, Larraga V [2006]. An intrinsic 5´-deoxyribose-5-phosphate lyase activity in DNA polymerase beta from Leishmania infantum supports role in DNA repair. DNA repair 5:89-101
Fondos
FUNDING GRANTS.
EUROLEISH-NET: Control of leishmaniasis, from bench to bedside and community. HORIZON 2020 - RESEARCH AND INNOVATION FRAMEWORK PROGRAMME. Grant agreement: 642609
ADVANCES IN THE DEVELOPMENT OF A DNA VACCINE AGAINST CANINE LEISHMANIASIS. MINECO. RTC-2014-1767-1
Cooperative Research Network. Instituo de Salud Carlos III. Notwork on Tropical Medicine![]() and International Health. 2009-2016.
and International Health. 2009-2016.
Más información
COLABORACIONES.
-Center for Infectious Disease Research (formerly Seattle Biomedical Research Institute). Prof. Peter Myler
-Centro de Biología Molecular "Severo Ochoa" (CSIC). Prof. Luis Blanco.
- Laboratorio de Ecología Molecular (Dr. Víctor Parro) del Centro de Astrobiología (INTA-CSIC).
- Servicio de Inmunología (Dr. Alfredo Toraño y Dra. Mercedes Domínguez) y Laboratorio de Parasitología (Dr. Ricardo Molina), Centro Nacional de Microbiología, Virología e Inmunología Sanitarias, Instituto de Salud![]() Carlos III.
Carlos III.
- Laboratorio de Parasitología. Dept de Patología Animal.(Drs.J.A. Castillo y J.Lucientes) facultad de veterinaria U. de Zaragoza![]() .
.
- Dep. de Parasitología (Drs. B. Valladares y E. Martinez), Facultad de Farmacia, Universidad de La Laguna, Tenerife.
- Dep. de Biología de Sistemas (Prof. Antonio Jiménez Ruiz), Facultad de Farmacia, Universidad de Alcalá de Henares.
- Instituto de Parasitología y Biomedicina "López Neyra".CSIC.Granada.Drs. MC.Thomas, MC López.


