Los virus son patógenos intracelulares estrictos que requieren una célula huésped para multiplicarse y expandir la infección. Han evolucionado para reprogramar vías clave en el huésped para obtener los intermedios metabólicos (nucleótidos, ácidos grasos o aminoácidos) necesarios para la biosíntesis de macromoléculas. Estos cambios desplazan el metabolismo celular hacia un estado anabólico que se asemeja al de las células cancerosas. Uno de los efectos más notorios es el conocido como “efecto Warburg” en el que las células utilizan preferentemente la glicolisis en lugar de la fosforilación oxidativa a pesar de la presencia de oxígeno. Por tanto, tanto las células cancerosas como las infectadas por virus presentan una alta captación de glucosa y una gran secreción de lactato. Los intermediarios glicolíticos y los metabolitos del ciclo de Krebs se utilizan como esqueletos carbonados para los procesos anabólicos, mientras que la vía de las pentosas fosfato (PPP) proporciona NADPH. La vía de las PPP también proporciona intermediarios para la síntesis de los nucleótidos necesarios para la síntesis de ADN / ARN. Además, al igual que las células tumorales, las células infectadas por virus muestran una alta dependencia de la glutamina, aumentando su captación y la actividad glutaminasa. La glutamina es convertida a a-cetoglutarato para reponer los intermediarios del ciclo de Krebs ya que el malato, oxaloacetato y citrato son exportados fuera de la mitocondria para proporcionar intermediarios para la biosíntesis de macromoléculas.
Los virus utilizan una variedad de estrategias para reprogramar el metabolismo del huésped utilizando vías de señalización que se encuentran en el centro del control del metabolismo. La vía de la fosfoinositol 3-quinasa (PI3K) - AKT y su diana mTOR son probablemente dos de las vías más importantes que estimulan el anabolismo en las células tumorales. Reseñar que ya se ha demostrado que varios virus activan PI3K para facilitar la replicación viral. El factor inducible por hipoxia (HIF) es otro actor clave en las adaptaciones metabólicas particularmente en el cáncer. HIF-1a induce la piruvato deshidrogenasa quinasa (PDK) que previene la oxidación mitocondrial del piruvato al inactivar la piruvato deshidrogenasa (PDH), la enzima que convierte el piruvato en acetil-CoA. HIF-1a también aumenta la captación de glucosa (induce transportadores GLUT) y facilita la conversión de piruvato en lactato estimulando la expresión de la lactato deshidrogenasa (LDH). Estos dos efectos concertados, inhibición de PDH y sobreexpresión de LDH, desplazan el metabolismo energético hacia la glicolisis. Es conocido que los virus utilizan diferentes mecanismos para activar HIF-1a, y su diana IL-1b, para mantener su replicación.
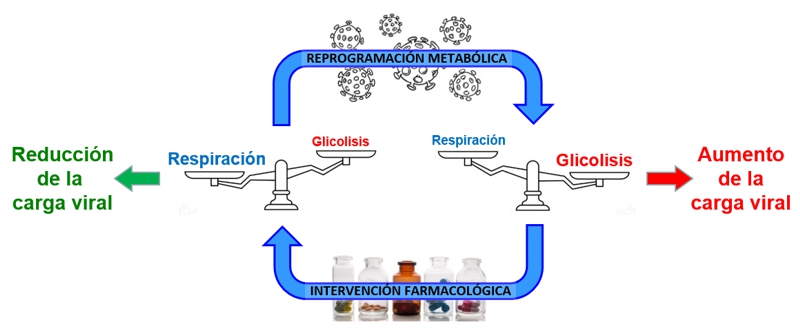
Nuestro proyecto de investigación tiene como objetivo identificar fármacos que reviertan la reprogramación metabólica inducida por virus en las células huésped. Se hace especial hincapié en el reposicionamiento de fármacos clínicos existentes como agentes antivirales.

