El mieloma múltiple (MM) es una neoplasia de células B caracterizada por la acumulación en la médula ósea de células plasmáticas malignas que producen proteínas monoclonales y causan lesiones de huesos, enfermedad renal e inmunodeficiencia.
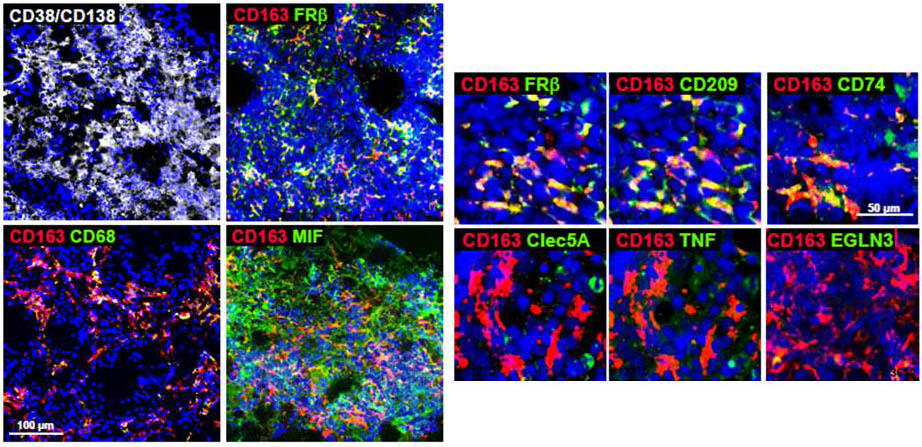
La supervivencia de las células MM en la médula ósea viene respaldada por su microentorno en la médula ósea, en concreto por los macrófagos (MØ). Un estudio publicado recientemente (Gutiérrez-González et al. Blood, 2016) demuestra que la combinación de las citoquinas GM-CSF junto con el inhibidor del factor MIF (factor inhibitorio de la migración de macrófagos) 4-IPP (4-yodo-6-fenil-pirimidina) resulta en una reprogramación eficiente de los macrófagos de tipo M2 (MM-macrófago asociado, tumor permisivo) a los antitumorales M1. De hecho, este tratamiento combinado provoca una respuesta terapéutica dependiente de MØ en modelos de ratón de xenotransplantes MM (células humanas en ratones inmunodeficientes). Así, la reprogramación de macrófagos podría constituir una estrategia terapéutica nueva y eficiente para tratar el mieloma múltiple.
Este trabajo ha sido dirigido por la Dr. Paloma Sánchez-Mateos del Hospital Gregorio Marañón, en colaboración estrecha con los grupos de los Drs. Joaquín Teixidó, Maria Angeles Garcia Pardo y Angel Corbí del CIB, así como con investigadores del CNIC, y los hospitales 12 de Octubre y Puerta de Hierro en Madrid, y el Hospital Universitario de Salamanca. Este estudio se realizó como parte del consorcio Neoplasbim y la Thematic Network for Cooperative Research in Cancer (RTICC), financiados por la Comunidad de Madrid y el Instituto de Salud Carlos III, respectivamente.

