Un artículo publicado en la revista International Journal of Biological Macromolecules por el grupo de RMN Biomolecular del Centro de Investigaciones Biológicas Margarita Salas (CSIC), liderado por el Dr. Francisco J. Blanco, describe la producción de la proteína PCNA incorporando un aminoácido no natural que mimetiza la fosforilación en residuos de tirosina y su efecto en el reconocimiento molecular de proteínas reguladoras de la replicación y reparación de ADN.
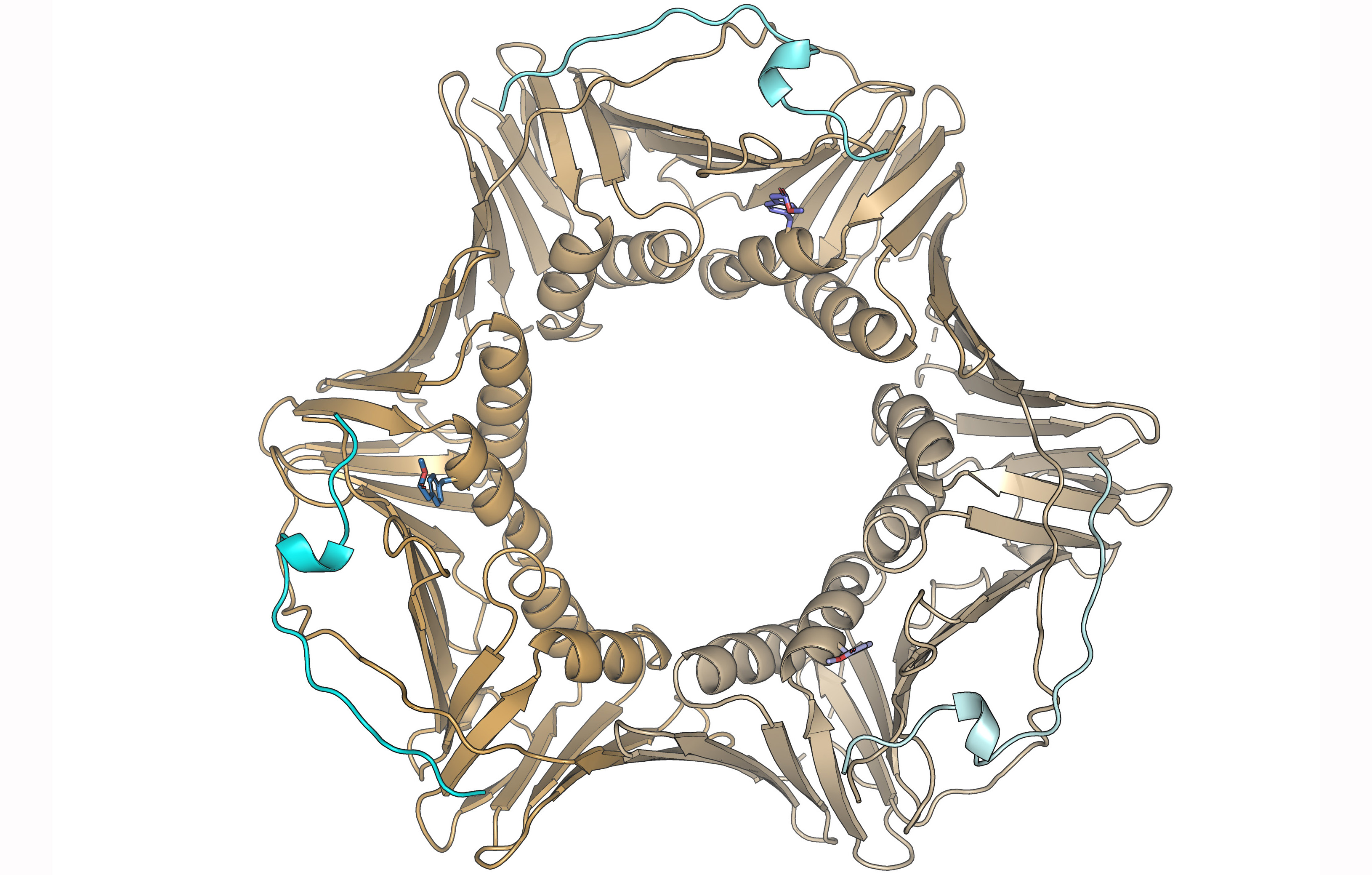
Ruíz-Albor et al. incorporaron el aminoácido para-carboximetil-L-fenilalanina en la posición de la tirosina nativa 211 de PCNA humana producida en cultivos bacterianos mediante co-expresión con un ARNt que lee el codón de terminación amber y de la enzima que le une a este aminoácido, añadidos al medio de cultivo. La incorporación, confirmada por espectrometría de masas, no modifica la estructura de la proteína, que forma un homotrímero con estructura de anillo. PCNA abraza el ADN y se desliza sobre la doble hélice anclando diferentes enzimas que modifican el ADN (helicasas, polimerasas, nucleasas y ligasas) además de proteínas reguladoras de su replicación y reparación. Estas proteínas se unen por una secuencia conservada llamada PIP (PCNA-interacting protein) a una región del protómero de PCNA cercana al residuo Tyr211, cuya fosforilación afecta a la estabilidad de la horquilla de replicación, como se observa en ensayos celulares.
La hipótesis del equipo de trabajo era que la fosforilación interfería con el reconocimiento molecular de otras proteínas a través de sus secuencias PIP, sin embargo, medidas cuantitativas de la afinidad por fragmentos correspondientes a las secuencias PIP de dos proteínas reguladoras (p21 y p15) muestran un efecto muy pequeño. La unión de las secuencias PIP de la ADN polimerasa delta, y de la deubiquitinasa USP29 es de muy baja afinidad y el efecto de la fosforilación no se pudo comprobar, aunque probablemente tampoco sea significativo.
Los resultados presentados en este trabajo apuntan a que el posible efecto se manifiesta solo en el contexto de la cromatina, aunque no se descarta la existencia de otro factor, aún no identificado y diferente del motivo de secuencia PIP, que pueda ser el responsable del efecto de la fosforilación de Tyr211 en la replicación del ADN.
Referencia:
Ruiz-Albor A, Chaves-Arquero B, Martín-Barros I, Guerra-Castellano A, Gonzalez-Magaña A, de Opakua AI, Merino N, Ferreras-Gutiérrez M, Berra E, Díaz-Moreno I, Blanco FJ. PCNA molecular recognition of different PIP motifs: Role of Tyr211 phosphorylation. Int J Biol Macromol. 2024 Jun 14;273(Pt 2):133187. doi: 10.1016/j.ijbiomac.2024.133187.

