Un estudio publicado recientemente en Chemistry a European Journal por el grupo de Sonsoles Martín-Santamaría y realizado en el Centro de Investigaciones Biológicas Margarita Salas (CSIC) ha proporcionado los modelos tridimensionales más realistas y completos hasta la fecha del Receptor Toll-like 4 (TLR4) en complejo con un LPS agonista, embebido en un modelo de membrana realista. Los modelos se han obtenido mediante estudios computacionales que combinan cálculos ab initio, termodinámicos y docking molecular.
El TLR4 es un receptor de membrana de suma importancia como diana terapéutica siendo uno de los principales actores de la inmunidad innata. Su ensamblaje, tras la unión del lipopolisacárido (LPS) de las bacterias Gram negativo, es dependiente de la composición de la membrana, y desencadena la cascada de la respuesta inmune.
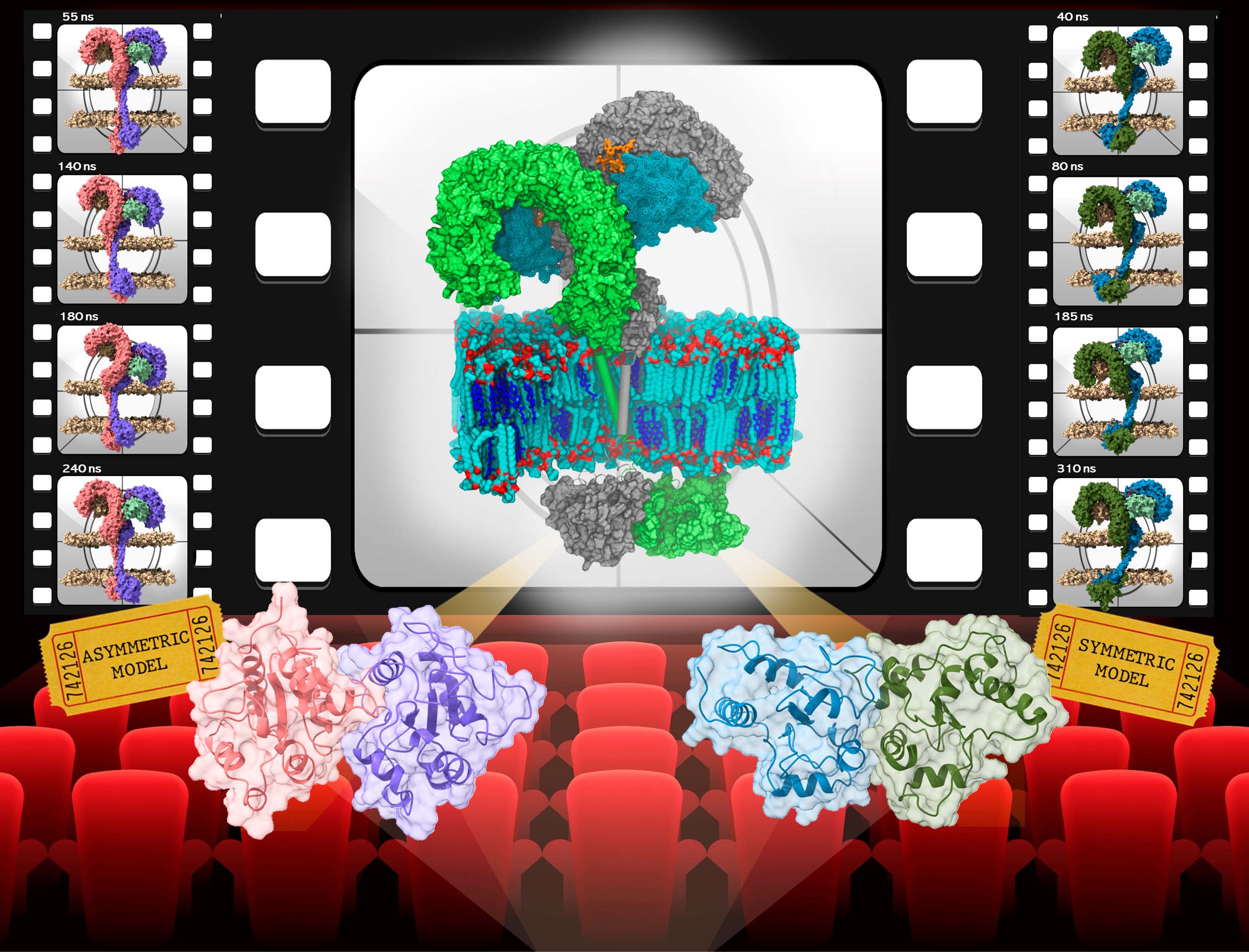
Matamoros-Recio et al. brindan información funcional y estructural sobre el comportamiento del dominio transmembrana en diferentes entornos de membrana, aportando datos clave sobre la necesidad del receptor TLR4 de migrar a determinados dominios de la membrana plasmática denominados balsas lipídicas para su activación, la interacción intermitente entre el dominio extracelular y la membrana, lo que da lugar a un movimiento de rebote del ectodominio de TLR4, y presentan posibles patrones de dimerización del dominio intracelular que pueden coexistir.
En base a cálculos termodinámicos, los autores proponen dos modelos, denominados TD2-simétrico y TD1-asimétrico, como conformaciones favorables del receptor TLR4 completo activado por LPS, y localizado en los microdominios de balsas lipídicas de la membrana. Además, desde el punto de vista molecular, demuestran que ambos modelos son capaces de reclutar la proteína citosólica adaptadora MAL, en su forma monomérica o dimérica, indispensable para desencadenar la cascada de señalización celular.
Por tanto, se sugiere que ambos modelos de TLR4 podrían coexistir y tener una implicación directa en la activación de distintas vías de señalización mediadas por este receptor. Por otro lado, el estudio termodinámico de ambos modelos indica que las energías más favorables se alcanzan cuando el dominio extracelular se inclina hacia la membrana, interaccionando con los fosfolípidos de esta, lo que apunta a un mecanismo de transducción de señal a través de la membrana celular, mediado por interacciones lípido-TLR4.
Por lo tanto, los resultados relacionados con el efecto de la composición de la membrana sobre la estructura y la dinámica del TLR4 son de particular importancia biológica debido a su papel en los eventos de transducción de señales. En esta interacción receptor-lípido, se puede especular que el movimiento de rebote dinámico observado para el ectodominio de TLR4 es un comportamiento adecuado en estos receptores de membrana que pueden funcionar como antenas para detectar patógenos. Estas observaciones revelan aspectos moleculares relevantes involucrados en la vía inmune innata relacionada con TLR4, lo que abre nuevas oportunidades para avanzar en la modulación de TLR4.
Este trabajo también ha sido seleccionado como portada de la misma revista, a la que se puede acceder aquí.
Referencia: Full-Atom Model of the Agonist LPS-Bound Toll-like Receptor 4 Dimer in a Membrane Environment. Matamoros-Recio A, Franco-Gonzalez JF, Perez-Regidor L, Billod JM, Guzman-Caldentey J, Martin-Santamaria S. Chemistry. 27, 15406-25 (2021). doi: 10.1002/chem.202102995.

