La división celular bacteriana en muchos organismos implica un anillo citoquinético constrictivo que es orquestado por la proteína, de tipo tubilina, FtsZ. FtsZ forma filamentos dinámicos cercanos a la membrana en el sitio de división que recientemente se ha descubierto se disponen en organización cabeza-cola alrededor del anillo de división, guiando la síntesis de la pared septal.
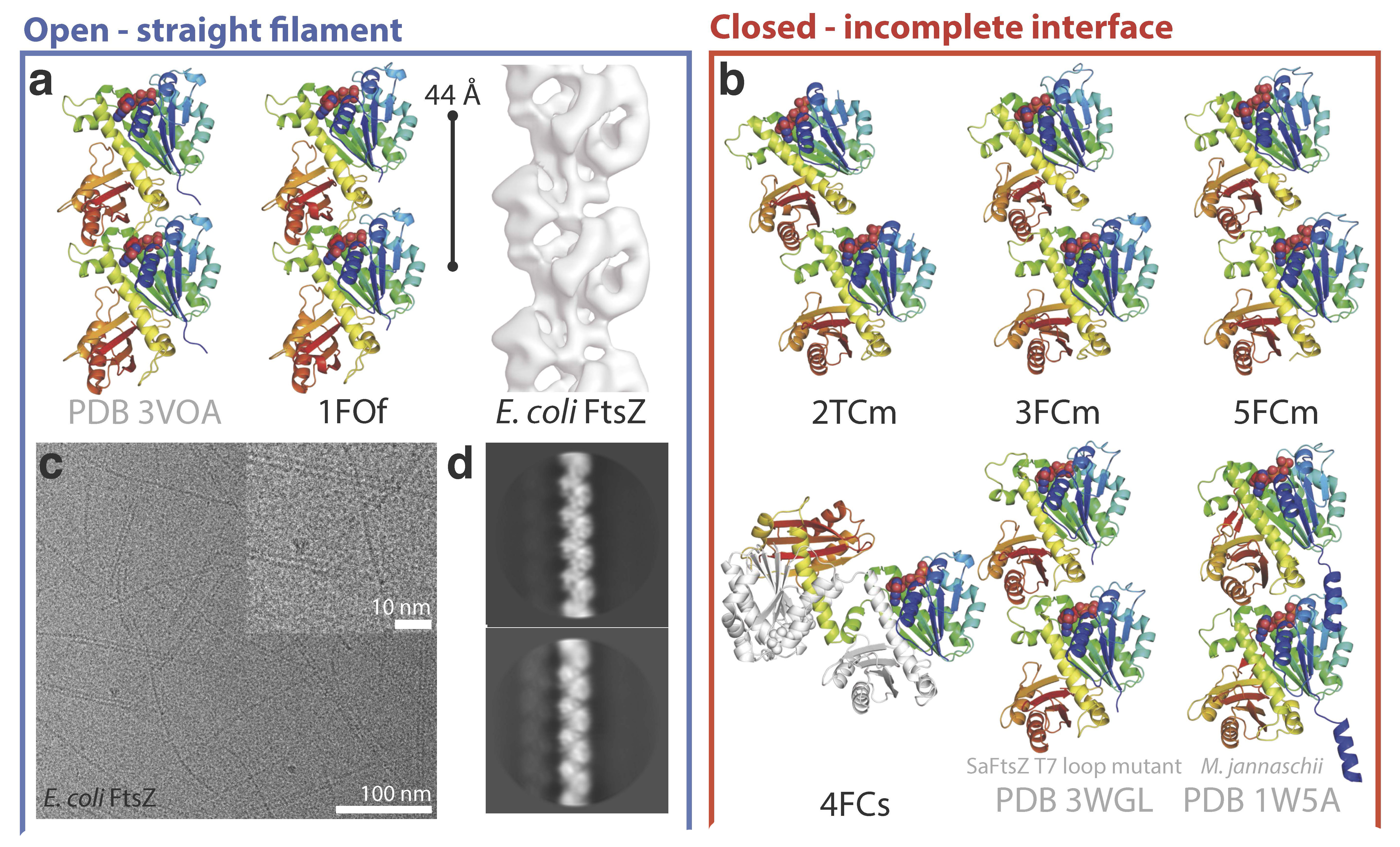
Un nuevo estudio publicado en mBIO por los grupos de Jan Löwe en el MRC-LMB y José Manuel Andreu en el CIB ha revelado ahora cómo FtsZ puede adoptar dos conformaciones funcionalmente distintas, abierta y cerrada, usando datos de cristalografía de rayos X de Staphylococcus aureus, SaFtsZ, combinados con ensayos bioquímicos.
El interruptor de ensamblaje de FtsZ había sido bioquímicamente demostrado antes en CIB. Para este trabajo, se diseñaron y caracterizaron mutantes FtsZ no polimerizables, mediante los cuales los autores muestran el mecanismo estructural del interruptor. La estructura abierta se encuentra en filamentos SaFtsZ formados en cristales y también en filamentos solubles de FtsZ de Escherichia coli, como se deduce por cryoEM. La estructura cerrada se encuentra en varias formas cristalinas de SaFtsZ no polimerizante y corresponde a muchas estructuras de FtsZ determinadas anteriormente para otros organismos.
En conjunto, estos resultados indican que FtsZ presenta un interruptor conformacional asociado a la polimerización. Dicho interruptor proporciona explicaciones tanto para el modo en que puede ocurrir el emparejamiento cabeza-cola dentro de un filamento monocatenario, como para el hecho de que el ensamblaje de los filamentos es cooperativo, dos características previamente consideradas exclusivas de filamentos de múltiples cadenas.
Referencia: A polymerisation-associated structural switch in FtsZ that enables treadmilling of model filaments. James Mark Wagstaff, Matt Tsim, María A Oliva, Alba García-Sanchez, Danguole Kureisaite-Ciziene, Jose M Andreu, Jan Löwe. mBIO (2017) 8, e00254-17

