Un trabajo publicado en Nature Communications por el grupo de la Dra. Federica Bertocchini y liderado por el Dr. Clemente F. Arias propone que la respuesta defensiva de las bacterias frente a los fagos varía según la velocidad a la que el virus se replica dentro de las células infectadas. El estudio indica que las bacterias seleccionarían el suicidio celular (sistemas Abi) frente a infecciones rápidas, pero aplicarían memoria inmunológica (sistema CRISPR) frente a virus de fagos lentos.
La coordinación entre la inmunidad innata y la adaptativa surgiría de forma natural de las tasas de actividad de las enzimas que participan en la respuesta antifagos. Este enfoque sugiere la existencia de un mecanismo molecular simple que explicaría la elección de las bacterias de incorporar nuevos fagos a la memoria inmune.
Los virus que infectan las células bacterianas (conocidos como bacteriófagos o fagos) son las entidades biológicas más abundantes en la Tierra. Las bacterias han desarrollado una variedad de mecanismos inmunológicos para defenderse de los ataques de fagos. Estos mecanismos van desde enzimas nucleasas que detectan y destruyen ADN extraño hasta conjuntos de proteínas (etiquetadas como sistemas Abi) que desencadenan el suicidio de la célula infectada para evitar la propagación del fago entre la población. Las células bacterianas también pueden realizar un seguimiento de infecciones pasadas. Los sistemas CRISPR, que se han convertido en una poderosa herramienta biotecnológica en los últimos años, escinden y almacenan fragmentos de ADN del fago, creando una memoria inmune que luego puede usarse contra el fago en caso de futuras reinfecciones.
Aunque se han descrito muchos de los mecanismos inmunes bacterianos, los aspectos básicos que subyacen a los mismos siguen sin explicarse. Por ejemplo, no todas las infecciones por fagos implican el suicidio de la célula infectada o la creación de nueva memoria inmunológica y aún no se ha desvelado la forma en que las células bacterianas deciden qué mecanismo inmunológico utilizar en cada episodio concreto de infección.
Para abordar esta cuestión, Arias et al. han formulado modelos matemáticos que simulan los eventos intracelulares que tienen lugar durante las infecciones por fagos. Los fagos interactúan con la inmunidad del huésped de formas complejas y explorar la dinámica que surge de estas interacciones es clave para comprender el resultado de las respuestas antifagos. Con ese fin, el modelado matemático proporciona información valiosa que sería inalcanzable utilizando solo descripciones cualitativas.
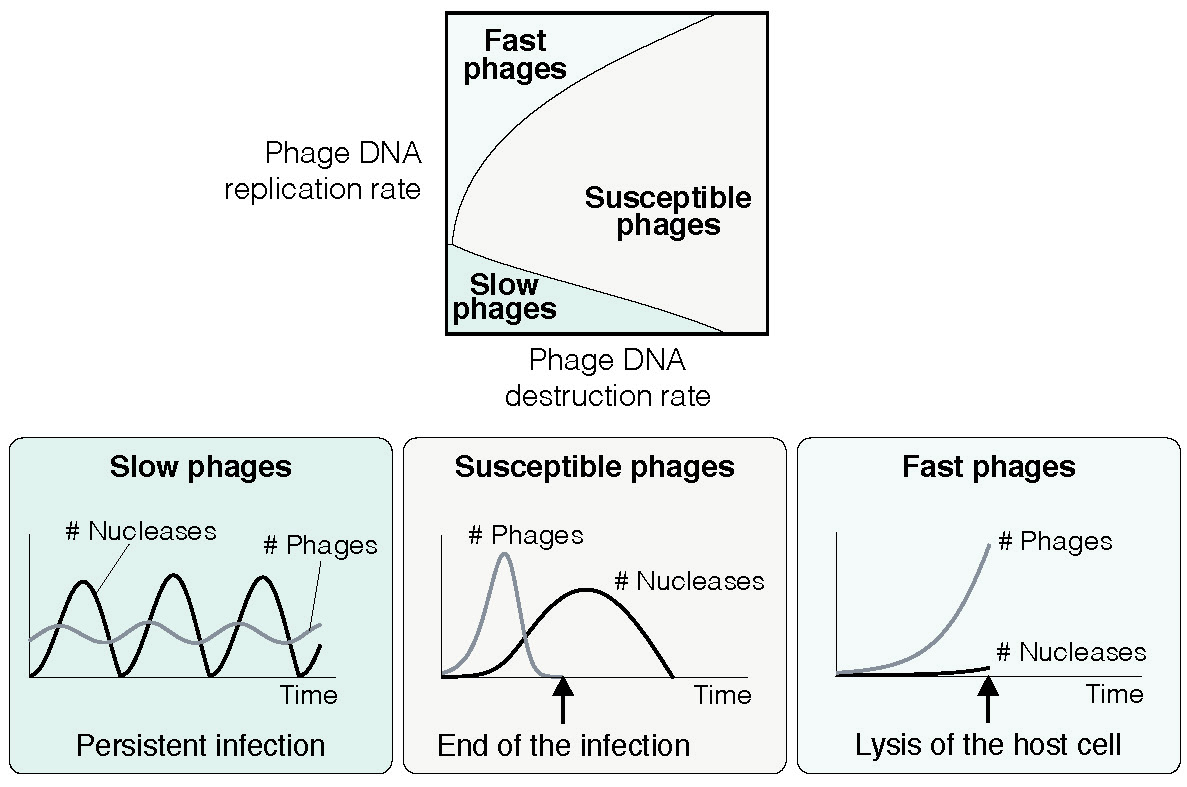
Según los modelos propuestos por los investigadores, los fagos pueden utilizar dos estrategias alternativas para evadir la inmunidad bacteriana. En primer lugar, pueden superar la respuesta inmunitaria del huésped al replicarse muy rápido. En segundo lugar, y de manera menos intuitiva, la replicación muy lenta también permitiría que los fagos engañen la inmunidad del huésped. Al mantener un perfil bajo, los fagos crearían infecciones persistentes y crónicas en las poblaciones bacterianas, un fenómeno desconcertante conocido como el ciclo de vida del estado de portador.
Los modelos sugieren que los sistemas Abi y CRISPR se dirigen a fagos rápidos y lentos respectivamente. El suicidio celular sería la mejor solución para combatir los fagos que se replican demasiado rápido para ser atacados por las defensas inmunitarias bacterianas. Por otro lado, la memoria inmune bacteriana solo sería efectiva contra fagos que se replican lentamente. En consecuencia, las células bacterianas podrían discriminar entre fagos rápidos y lentos e incorporar selectivamente estos últimos en su memoria CRISPR.
El estudio proporciona una imagen coherente de la inmunidad bacteriana y arroja luz sobre cómo funcionan los mecanismos antifagos dentro de las células infectadas. Los resultados también contribuyen a una mejor comprensión de cómo funcionan los sistemas CRISPR durante las infecciones por fagos, lo que podría ayudar a mejorar sus aplicaciones biotecnológicas.
El trabajo es fruto de una colaboración entre el CIB Margarita Salas (CSIC), la Universidad Complutense de Madrid y el Instituto de Medicina Molecular de Lisboa.
Referencia: The coordination of anti-phage immunity mechanisms in bacterial cells. Clemente F. Arias, Francisco J. Acosta, Federica Bertocchini, Miguel A. Herrero, Cristina Fernández-Arias (2022) Nat Commun. DOI: https://doi.org/10.1038/s41467-022-35203-7
Más información:
Nota de Prensa del CSIC: link.

