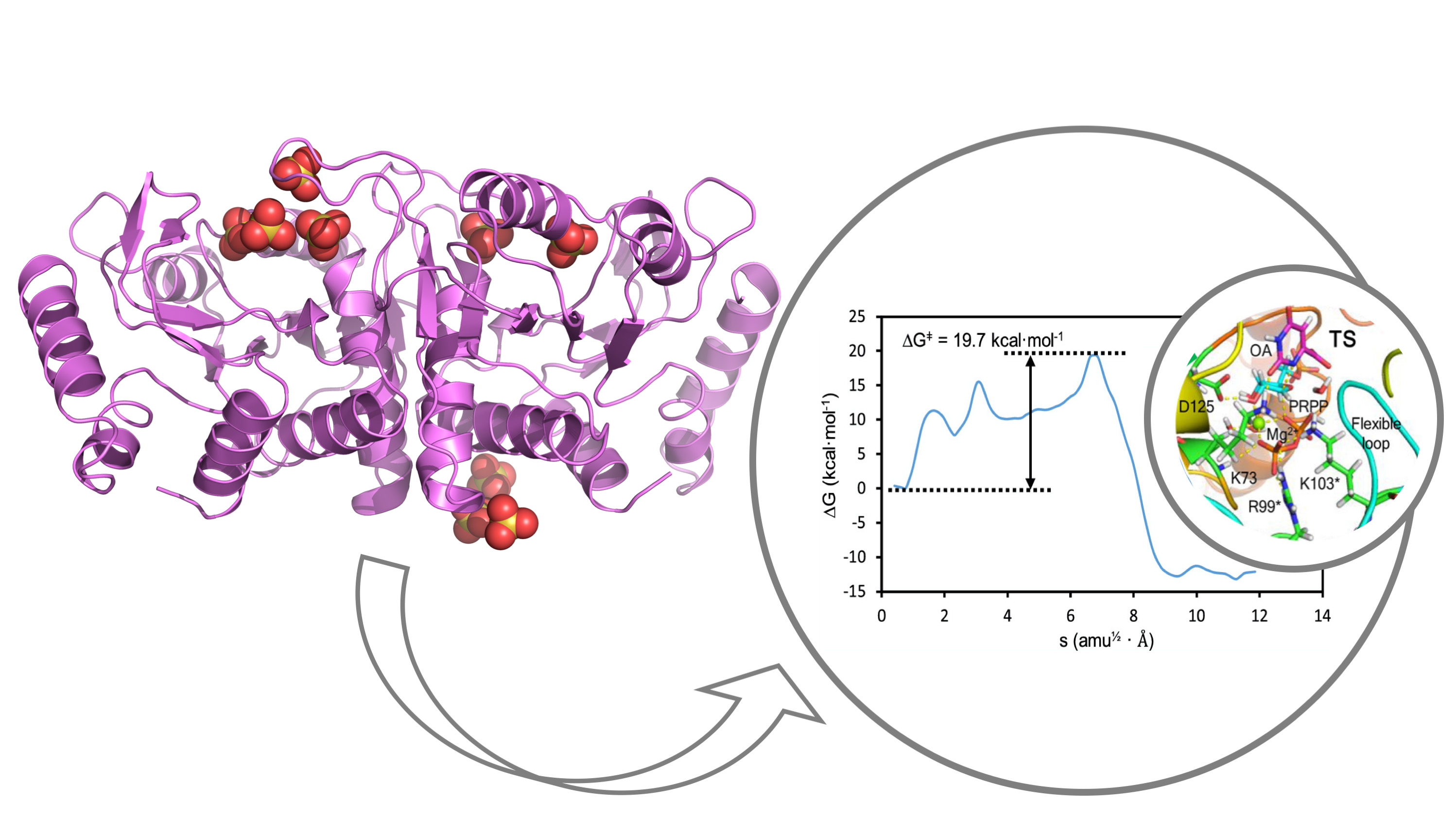
Un trabajo publicado recientemente en ACS Catalysis por el grupo de Biología Estructural de las Interacciones Huésped-Patógeno dirigido por la Dra. Mª Cristina Vega del Centro de Investigaciones Biológicas Margarita Salas (CSIC), en colaboración con el grupo del Dr. Iñaki Tuñón (Universitat de València), desvela el mecanismo detallado de un enzima clave para la biosíntesis de bases de pirimidina, ruta esencial para la síntesis de ácidos nucleicos.
El enzima, Orotato fosforibosiltransferasa (OPRTasa), cataliza la reacción entre el donador de ribosa α-D-5-fosforibosil-1-pirofosfato (PRPP) y ácido orótico en presencia de Mg2+ para obtener pirofosfato y orotidina 5′-monofosfato (OMP), un precursor clave en la biosíntesis de novo de nucleotidos de pirimidina. La intervención farmacológica a nivel de enzima OPRTasa ha demostrado comprometer la supervivencia de importantes patógenos humanos como el parásito de la malaria (Plasmodium falciparum) y el bacilo de la turbeculosis (Mycobacterium tuberculosis). Además, el enzima OPRTasa ha sido propuesto como diana relevante en terapias anticancerígenas debido al elevado suplemento de nucleotidos de pirimidina requerido para sostener la rápida replicación de las células neoplásicas.
En este trabajo, el grupo de la Dra. Vega determinó la estructura cristalográfica de varias formas de una OPRTasa modelo a alta resolución, generando estructuras tridimensionales de alta calidad para cálculos computacionales de QM/MM y de dinámica molecular realizados por el grupo del Dr. Tuñón. Además, se caracterizó la cinética enzimática de la reacción con el objeto de comparar la energía de la barrera de activación de mecanismos de reacción alternativos. El mecanismo enzimático desvelado determina que la reacción depende críticamente de una conformación amida inicial del substrato orotato y de una molécula de agua localizada en una posición específica. Todo ello ha permitido, tras décadas de controversia, desvelar la estructura del estado de transición de la reacción catalizada por OPRTasa. Los resultados de este trabajo establecen la vía para el descubrimiento de nuevos compuestos para la inhibición farmacológica y la modulación de una ruta metabólica esencial como es la biosíntesis de novo de nucleótidos de pirimidina.
Reference: “Elucidating the Catalytic Reaction Mechanism of Orotate Phosphoribosyltransferase by Means of X-ray Crystallography and Computational Simulations”. Roca M*, Navas-Yuste S, Zinovjev K, López-Estepa M, Gómez S, Fernández FJ, Vega MC*, Tuñón I* (2020) ACS Catalysis, 10, 1871-1885. DOI:10.1021/acscatal.9b05294

