Un trabajo publicado en la revista Journal of Thrombosis and Haemostasis por el grupo del Dr. Carmelo Bernabeu en colaboración con la Dra. M. Cristina Vega, ambos investigadores del Centro de Investigaciones Biológicas Margarita Salas (CIB-CSIC), demuestra que una forma circulante de endoglina, conocida como endoglina soluble (sEng), actúa como un nuevo regulador de la hemostasia primaria y procesos tromboinflamatorios. Este hallazgo es resultado de una colaboración internacional que ha implicado también a los equipos de la Dra. Elisa Rossi de la Universidad Paris Cité (Francia) y del Dr. Miguel Pericacho de la Universidad de Salamanca.
sEng es un producto de escisión de la endoglina unida a membrana que se expresa en el endotelio. Estudios previos habían descrito niveles elevados de sEng en plasma en diversas enfermedades relacionadas con el sistema circulatorio y cardiovascular, incluyendo la aterosclerosis, preeclampsia, infarto de miocardio, diabetes, e hipertensión. Sin embargo, su papel en el proceso de hemostasis era desconocido. Dado que las plaquetas juegan un papel esencial en la hemostasis mediada por las integrinas y debido a que sEng contiene una secuencia Arginina-Glicina-Acido aspártico (RGD) involucrada en la unión a integrinas, los autores plantearon la hipótesis de que sEng podría unirse a la integrina plaquetaria αIIbβ3. Esta integrina es fundamental para la unión de las plaquetas al fibrinógeno y para la estabilidad del trombo.
Rossi et al. realizaron ensayos de agregación de plaquetas humanas in vitro, retracción de trombos y competición de secreción en presencia de sEng. En condiciones de flujo, la suplementación de sangre humana con sEng condujo a un tamaño de trombo más pequeño. Además, sEng inhibió la agregación plaquetaria y la retracción del trombo, interfiriendo con la unión del fibrinógeno, pero sin afectar la activación plaquetaria.
Análisis computacionales y de unión por resonancia de plasmones superficiales (SPR) permitieron evaluar las interacciones proteína-proteína. Los estudios de unión de SPR demostraron la interacción específica entre αIIbβ3 y sEng y el modelado molecular mostró un buen ajuste entre las estructuras αIIbβ3 y sEng que involucran el motivo RGD de sEng, lo que sugiere la formación de un αIIbβ3/sEng altamente estable.
Adicionalmente, se usó un ratón transgénico que sobreexpresa sEng humana (hsEng+) para medir el sangrado/resangrado, el tiempo de protrombina (PT) y la formación de émbolos después de una lesión de la arteria carótida inducida por FeCl3. Así, los ratones hsEng+ mostraron un aumento del tiempo de sangrado y el número de resangrados en comparación con los ratones control. Sin embargo, no se observaron diferencias en el PT entre los genotipos. Después de la lesión por FeCl3, el número de émbolos liberados en ratones hsEng+ fue mayor y la oclusión fue más lenta en comparación con los controles.
Estos resultados demuestran que sEng interfiere con la formación y estabilización de trombos, probablemente a través de su unión a las plaquetas αIIbβ3, lo que indica su participación en el control de la hemostasia primaria, y abre nuevas vías terapéuticas en procesos tromboinflamatorios.
Referencia: Soluble endoglin reduces thrombus formation and platelet aggregation via interaction with αIIbβ3 integrin. Rossi E, Pericacho M, Kauskot A, Gamella-Pozuelo L, Reboul E, Leuci A, Egido-Turrion C, El Hamaoui D, Marchelli A, Fernández FJ, Margaill I, Vega MC, Gaussem P, Pasquali S, Smadja DM, Bachelot-Loza C, Bernabeu C. J Thromb Haemost. 2023 Mar 27: S1538-7836(23)00254-4. doi: 10.1016/j.jtha.2023.03.023
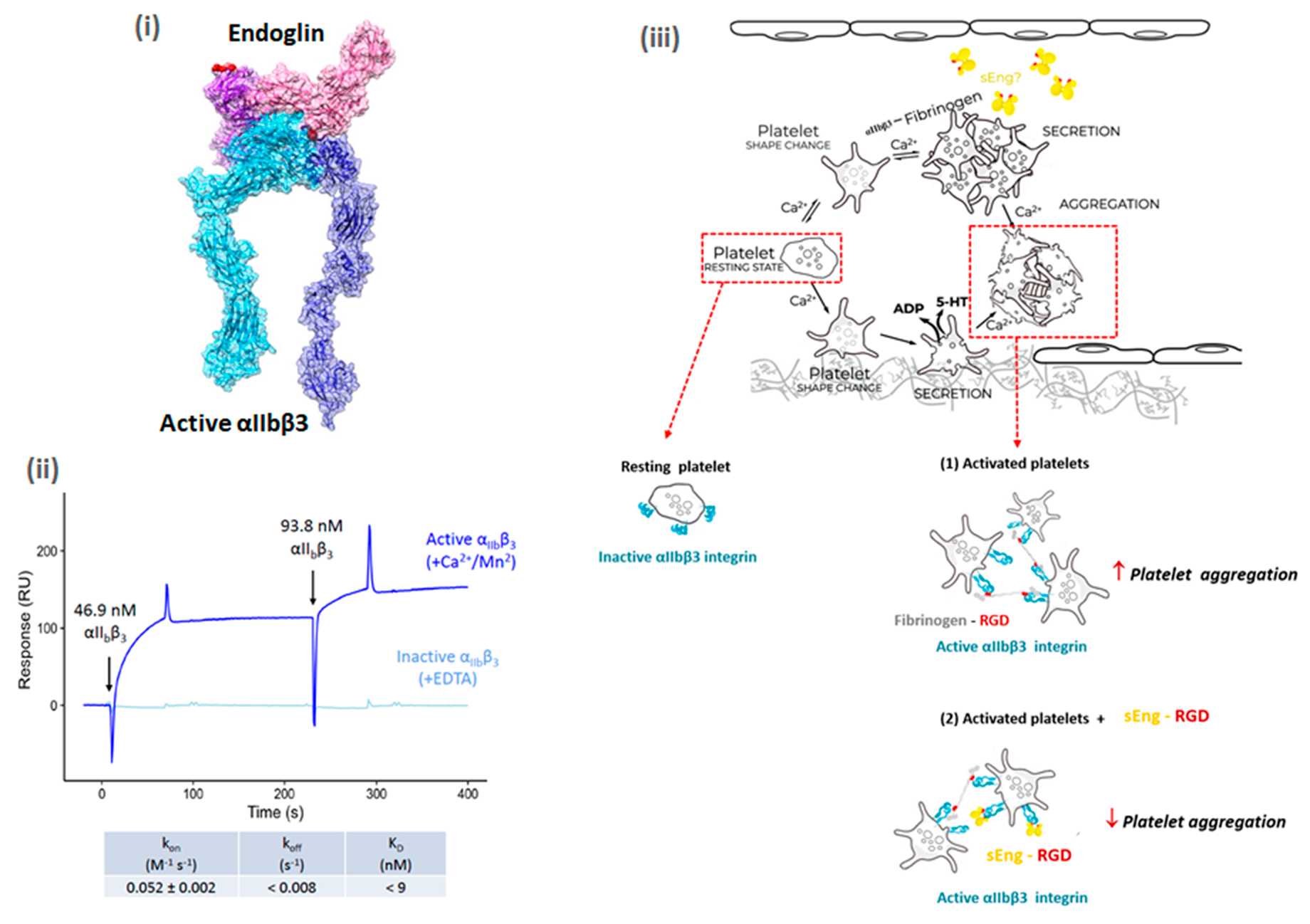
[PIE DE FIGURA]
(i) Modelado estructural (Docking) del complejo entre la integrina activa αIIbβ3 (azul oscuro- claro) y sEng (rosa oscuro- claro). El motivo RGD de sEng está marcado en rojo.
(ii) Análisis de unión de sEng e integrina αIIbβ3 activa o inactiva mediante resonancia de plasmón superficial. El sensorgrama corresponde a las dos primeras inyecciones consecutivas del ligando (integrina αIIbβ3) sobre el chip sensor inmovilizado con sEng.
(iii) Mecanismo hipotético de inhibición de la agregación plaquetaria inducida por sEng. Las plaquetas circulantes son atraídas al lugar de la lesión mediante interacciones adhesivas, incluida la unión entre la endoglina endotelial unida a la membrana y la αIIbβ3 plaquetaria. Tras la activación, las plaquetas se segregan y se agregan entre sí mediante interacciones de las plaquetas con el fibrinógeno mediadas por la integrina αIIbβ3. La endoglina unida a la membrana puede procesarse proteolíticamente para producir una forma soluble de endoglina (sEng) que contiene un motivo RGD. Las plaquetas en reposo presentan la integrina αIIbβ3 inactiva en su superficie, pero tras la estimulación plaquetaria, la integrina αIIbβ3 se activa permitiendo la formación de interacciones fibrinógeno-αIIbβ3 mediadas por el motivo RGD que conducen a la agregación plaquetaria (1). La sEng se une a la αIIbβ3 a través de su motivo RGD, induciendo una desestabilización del trombo al "interferir" con las interacciones fibrinógeno-αIIbβ3 e inhibiendo así la agregación plaquetaria (2).

