Investigadores de cinco instituciones españolas han descubierto nuevos mecanismos moleculares que promueven la generación de células T reguladoras (Tregs) que desempeñan un papel clave en el desarrollo y la progresión de tumores. El trabajo ha sido publicado en Nature Cellular & Molecular Immunology y ha contado con la participación del grupo de RMN y reconocimiento molecular dirigido por el Dr. Francisco Javier Cañada en el Centro de Investigaciones Biológicas Margarita Salas (CIB-CSIC).
Las Tregs son una subpoblación especializada de células T que suprimen las respuestas inmunitarias anormales o excesivas para mantener la homeostasis inmunitaria. Si bien desempeñan un papel fundamental en la prevención de la autoinmunidad, por otra parte, las Tregs participan en el desarrollo y la progresión de tumores al inhibir la inmunidad antitumoral. Aún no se han comprendido del todo los mecanismos por los cuales se generan estas células. Se sabe que las células dendríticas −que son cruciales en orquestar las respuestas inmunes− se infiltran en los tumores donde promueven la activación de las Tregs; no obstante, aún se desconocen las bases moleculares de estos mecanismos.
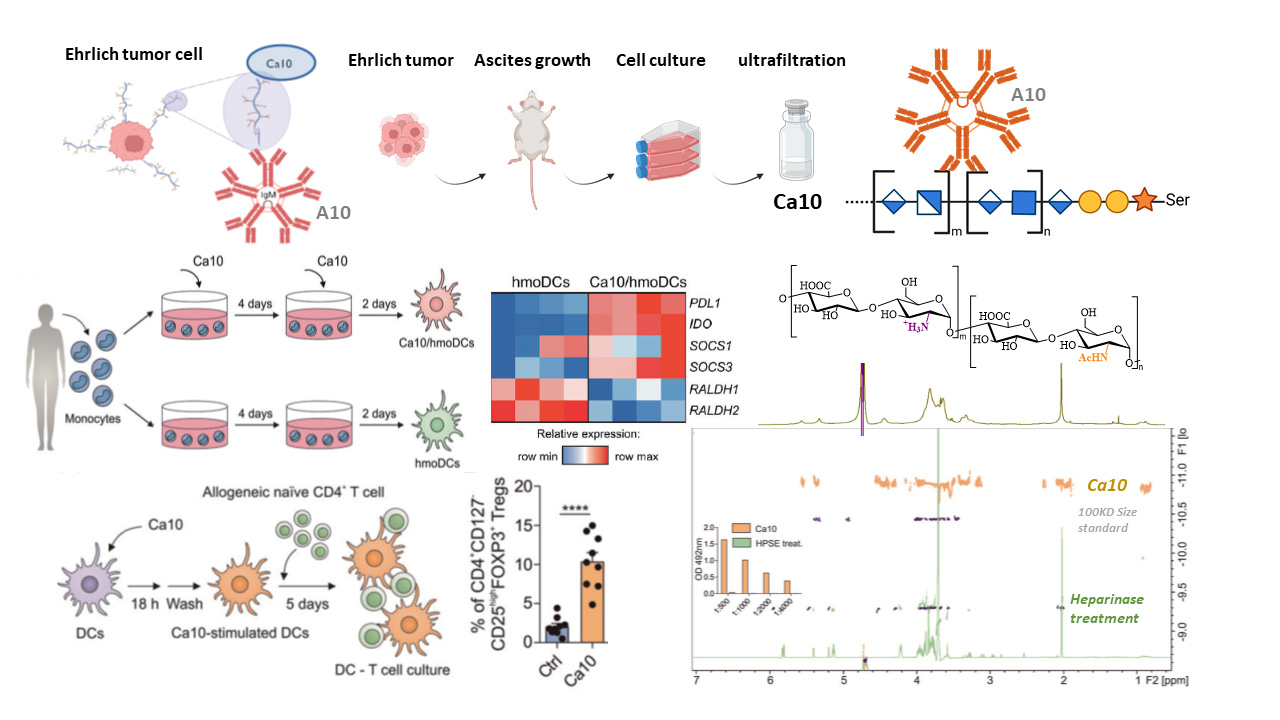
La transformación maligna de las células se acompaña por cambios en sus componentes de superficie que juegan un papel en impulsar la progresión del tumor. Se ha descrito que los carbohidratos derivados de las células tumorales pueden inhibir la inmunidad anticancerígena a través de diferentes mecanismos. Sin embargo, todavía no se ha comprendido si esos carbohidratos desencadenan la generación de Tregs funcionales, ni los mecanismos moleculares subyacentes. Ahora, Martín-Cruz et al. demuestran que un carbohidrato de superficie derivado de un tipo específico de células tumorales desencadena la generación de Tregs a través de las células dendríticas.
El carbohidrato A10 (Ca10) es una macromolécula de superficie de las células del tumor de Ehrlich murino (ET) que se libera espontáneamente de ellas y puede detectarse en el suero de ratones portadores de ET sólidos. Investigaciones previas han demostrado que el Ca10 es una macromolécula altamente glicosilada. Ahora, los estudios de resonancia magnética nuclear realizados por el grupo del Dr. Cañada en el CIB Margarita Salas, han demostrado que la estructura del Ca10 es principalmente un glicosaminoglicano relacionado con el heparán sulfato. Además, experimentos de inhibición farmacológica y ensayos funcionales realizados en esta investigación muestran que el glicosaminoglicano del Ca10 es esencial para la inducción de células dendríticas con capacidad de generar Tregs funcionales.
Los investigadores han encontrado también correlaciones positivas entre los niveles séricos de Ca10, el tamaño del tumor y el número de Tregs en el bazo en ratones portadores de ET sólido, y describen que la administración de Ca10 a ratones libres de tumores aumenta significativamente la proporción de estas células en el bazo. Además, el trabajo proporciona evidencia de un homólogo de Ca10 humano (Ca10H) y muestra, por primera vez, que los niveles de ese carbohidrato aumentan en el suero de pacientes que padecen diferentes tipos de cáncer en comparación con controles sanos y, por otro lado, que en pacientes con cáncer de próstata los niveles de Ca10H se correlacionan con las metástasis óseas.
Este trabajo revela nuevos mecanismos moleculares mediante los cuales los componentes de superficie Ca10 y Ca10H promueven la generación de Tregs funcionales en tumores. Esta nueva relación estructural-funcional tiene interés terapéutico y el trabajo abre nuevas vías de investigación con importantes implicaciones clínicas en el tratamiento del cáncer.
El trabajo es el resultado de una colaboración entre el CIB Margarita Salas, la Universidad Complutense de Madrid, el Hospital Clínico San Carlos, el CIBER de Enfermedades Respiratorias (CIBERES) y la empresa Inmunotek, y ha dado lugar a dos patentes.
Referencia: A tumor-associated heparan sulfate-related glycosaminoglycan promotes the generation of functional regulatory T cells. L. Martín-Cruz, M. Viñuela, I. Kalograiaki, A. Angelina, P. Oquist-Phillips, I. Real-Arévalo, F. J. Cañada, J. I. Tudela, L. Moltó, J. Moreno-Sierra, J. Lu. Subiza & O. Palomares. https://www.nature.com/articles/s41423-023-01096-9#

