Los poliésteres biodegradables representan un área de estudio de gran impacto para el sector biomédico. Ahora, un trabajo publicado en la revista International Journal of Biological Macromolecules y realizado por investigadores del grupo de Biotecnología de Polímeros liderado por Auxi Prieto en el Centro de Investigaciones Biológicas Margarita Salas (CIB-CSIC) ha llevado al desarrollo de pequeños péptidos de unión a materiales (MBP, por sus siglas en inglés) inspirados en la naturaleza. Los autores del estudio forman parte de SusPlast, Plataforma Temática Interdisciplinar del CSIC cuya misión es transformar la manera de diseñar, producir, usar y reciclar los plásticos para dirigirla hacia una economía circular.
Los poliésteres sintéticos, como el PET, se utilizan desde hace mucho tiempo en el sector sanitario, para la fabricación de implantes biomédicos. Esto se debe a sus propiedades de alta resistencia, durabilidad y versatilidad que pueden ser comparables a las de muchos tejidos del cuerpo. Sin embargo, el origen fósil, la naturaleza químicamente inerte y la resistencia a la biodegradación de estos materiales podrían causar ciertos inconvenientes, como dificultar la adhesión celular o la reabsorción del implante, entre otros. Por esta razón, los biopoliésteres pueden ser una opción más apropiada cuando se requiera biodegradabilidad.
Los polihidroxialcanoatos (PHAs) son poliésteres de origen bacteriano que representan una alternativa a los polímeros sintéticos en diversas aplicaciones médicas como suturas, implantes y sistemas de administración de medicamentos. A pesar de sus propiedades ventajosas, los PHAs suelen producirse como polímeros que carecen de grupos funcionales complejos. Por esta razón, en la actualidad hay creciente interés en lo que se define como ‘funcionalización’ de estos poliésteres: la incorporación de grupos funcionales específicos que les confieran ciertas características, con el fin de ampliar su rango de aplicación. La funcionalización de la superficie de los PHAs con péptidos, proteínas o incluso células enteras se ha sugerido como un enfoque versátil y simple para mejorar su aplicabilidad en el sector biomédico. Una estrategia sofisticada para ello se basa en conectar moléculas de interés -por ejemplo, proteínas bioactivas- a pequeños péptidos de anclaje que poseen propiedades intrínsecas de unión a materiales, obteniendo de esa manera un ensamblaje directo de moléculas bioactivas en varios biomateriales.
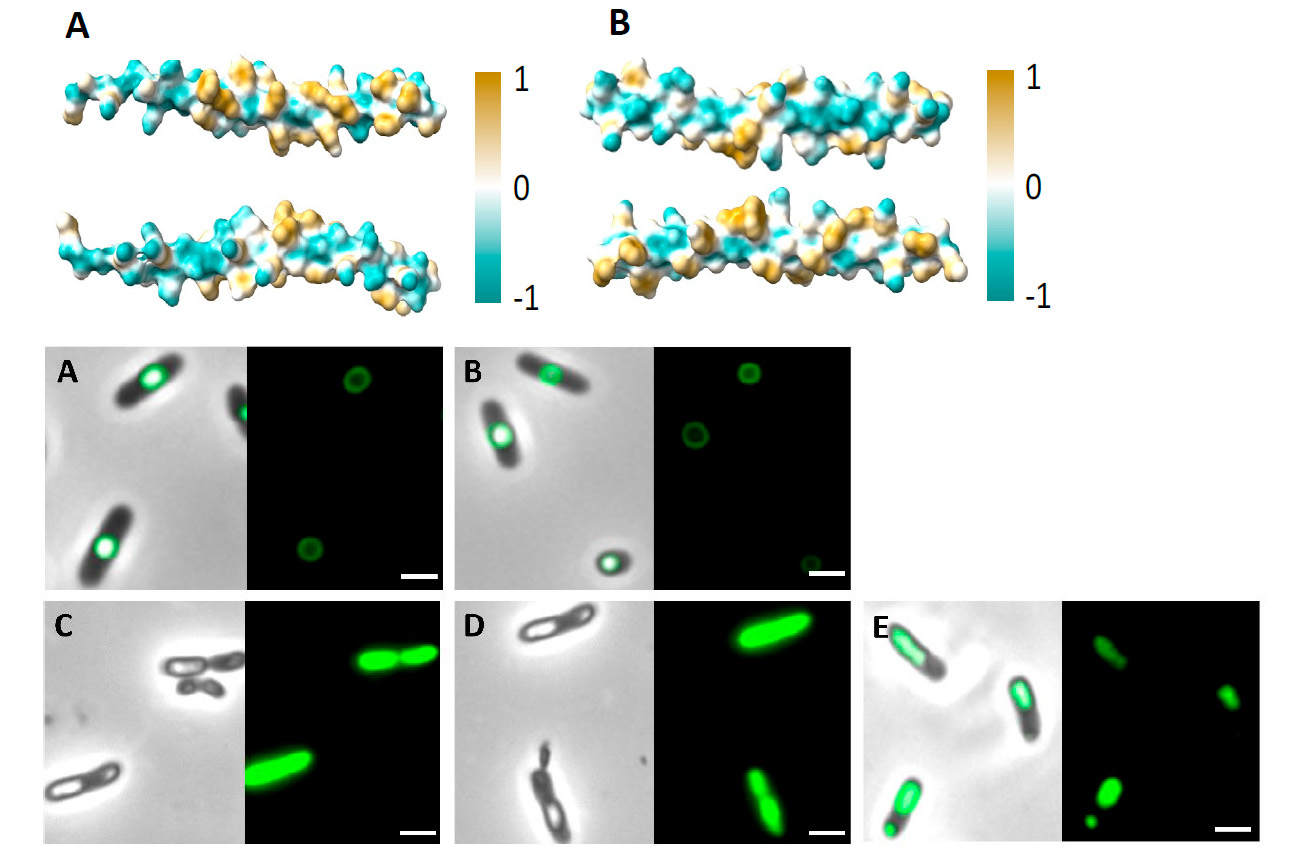
En este trabajo, los autores han diseñado y generado pequeños péptidos de anclaje, de 48 aminoácidos, con capacidad para ensamblar moléculas bioactivas en biomateriales como los PHAs. Para ello, se han inspirado en las fasinas, un grupo de proteínas de origen bacteriano, que poseen elevada afinidad hacia los PHAs. “Inspirándonos en las proteínas asociadas a gránulos existentes en la naturaleza, como son las fasinas, generamos pequeños MBP para la funcionalización de superficies de poliésteres”, escriben los autores.
Dentro de la célula, las fasinas se unen a los gránulos citoplasmáticos de PHAs. Esta propiedad se debe a la presencia de residuos hidrofílicos e hidrofóbicos en dos lados opuestos de la proteína, lo cual le confiere un carácter anfifílico. “Los péptidos generados en este trabajo, denominados MinP and MinI y derivados de las fasinas PhaF y PhaI de la bacteria Pseudomonas putida, se diseñaron siguiendo un enfoque racional basado en la anfifilicidad”, explica Ana M. Hernández-Arriaga, investigadora en el CIB y co-autora del trabajo. “Ambos péptidos presentaron una alta afinidad de unión hacia los dos tipos de PHA evaluados (PHB y PHOH), y poseen la capacidad de inmovilizar proteínas en la superficie del poliéster, lo que les convierte en candidatos ideales para la funcionalización de PHA”, continúa la científica.
La afinidad de unión de ambos péptidos hacia los PHAs se evaluó in vivo -en el citoplasma bacteriano- mediante marcaje-localización por fluorescencia, utilizando la proteína verde fluorescente (GFP, por sus siglas en inglés), e in vitro, mediante técnicas biofísicas, como la elipsometría y la balanza de Langmuir-Blodgett. “Además, hemos comprobado que estos péptidos también se unen a poliésteres sintéticos como el PET, lo que demuestra su potencial y versatilidad para unir moléculas bioactivas también a poliésteres no naturales”, añade Hernández-Arriaga. La capacidad de estos péptidos para unirse a poliésteres sintéticos respalda su posible uso, en un futuro, para aplicaciones que van más allá de la biomedicina.
Reference: Nature-inspired material binding peptides with versatile polyester affinities and binding strengths. F. G. Blanco, R. Machatschek, M. Keller, A. M. Hernández-Arriaga, M. S. Godoy, N. A. Tarazona, M. A. Prieto. DOI: 10.1016/j.ijbiomac.2023.126760

