La proteína PaaX es el mayor regulador de la ruta del ácido fenilacético en Escherichia coli, una ruta central para la degradación aeróbica bacteriana de compuestos aromáticos. En una colaboración internacional, investigadores de instituciones españolas, inglesas y australianas han conseguido elucidar la estructura tridimensional y la estabilidad de esta proteína. El estudio ha sido liderado por los investigadores Jesús Miguel Sanz Morales, del Centro de Investigaciones Biológicas Margarita Salas (CIB-CSIC), y Juan Hermoso, del Instituto de Química Física Blas Cabrera (IQF-CSIC), y se ha publicado en la revista International Journal of Biological Macromolecules.
Los compuestos aromáticos provienen de diversas fuentes y son abundantes en el suelo y el agua; son altamente resistentes a la biodegradación y su transformación biológica suele ser realizada por bacterias y hongos. En particular, la degradación del ácido fenilacético (PAA) y sus derivados puede ser llevada a cabo por varias bacterias y hongos, tanto en condiciones aeróbicas como anaeróbicas.
Las rutas de degradación del PAA constituyen la principal vía metabólica de biodegradación de compuestos aromáticos en bacterias, estando presentes en alrededor del 16 % del genoma bacteriano. Sin embargo, a pesar de su amplia presencia en el ámbito microbiano, el papel del PAA aún se desconoce en gran medida. Por otra parte, en algunos casos la ruta se ha relacionado con la acumulación de intermedios metabólicos tóxicos que promueven la virulencia de diversos patógenos. Por eso, el estudio de la ruta PAA y su regulación podría contribuir, no sólo a mejorar la aplicación de los microorganismos en procesos medioambientales y biotecnológicos, sino también a esclarecer problemas de salud como la patogenicidad bacteriana y la resistencia a los antimicrobianos.
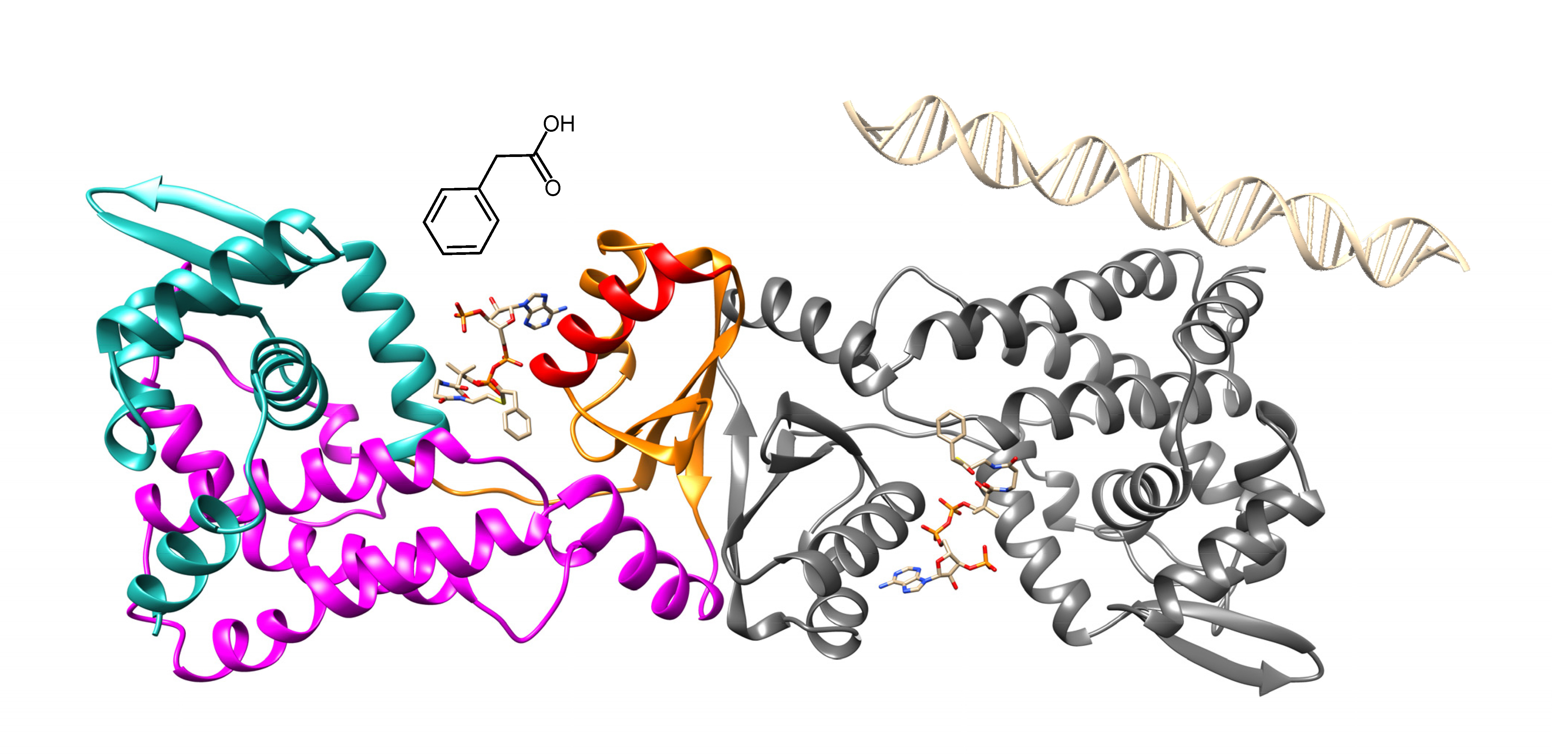
PaaX es un represor transcripcional de la vía de degradación aeróbica del PAA. En condiciones normales, PaaX está asociado a tres secuencias promotoras (Pa, Px y Pz) y a través de esta unión reprime la expresión de las enzimas de la ruta. El primer paso en la degradación aeróbica del PAA es su esterificación con coenzima A (CoA), lo que lleva a la formación de fenilacetil-coenzima A (PA-CoA). Cuando este compuesto se une a PaaX, este regulador se disocia de las secuencias genéticas a las que está asociado, provocando la activación de la ruta. A pesar de que se conoce este funcionamiento, todavía no se han comprendido los mecanismos por los cuales PaaX se une al ADN y a su inductor PA-CoA y por lo tanto reprime o permite la transcripción. Ahora, el trabajo publicado en International Journal of Biological Macromolecules ha permitido dilucidar la estructura cristalográfica de PaaX, proporcionando importantes pistas para comprender estos mecanismos.
El análisis estructural realizado en el estudio muestra que PaaX posee un nuevo tipo de plegamiento, que hasta ahora no se había observado en los represores de la transcripción en procariotas. Según sugieren los autores, estos resultados proporcionan información valiosa para comprender mejor la estabilidad y el mecanismo de PaaX y allanan el camino para análisis adicionales de otros reguladores con configuraciones estructurales similares.
Referencia: Structural characterization of PaaX, the main repressor of the phenylacetate degradation pathway in Escherichia coli W: A novel fold of transcription regulator proteins. V. M. Hernández-Rocamora, R. Molina, A. Alba, C. Carrasco-López, A. Rojas-Altuve, S. Panjikar, A. Medina, I. Usón, C. Alfonso, B. Galán, G. Rivas, J. A. Hermoso, J. M. Sanz. https://doi.org/10.1016/j.ijbiomac.2023.127935

