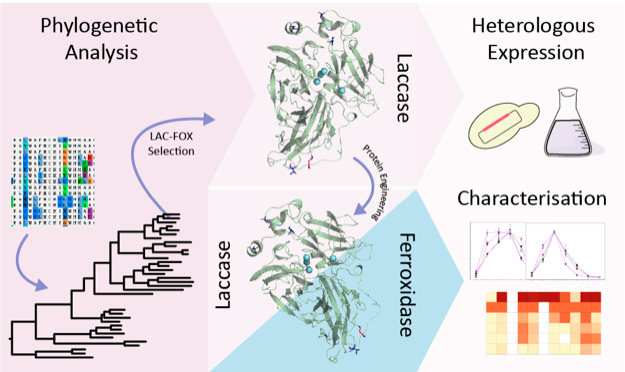
Un trabajo publicado recientemente en la revista Computational and Structural Biotechnology Journal por el grupo dirigido por la Dra. Susana Camarero en el Centro de Investigaciones Biológicas Margarita Salas (CSIC) ha puesto de manifiesto la existencia de dos ramas evolutivas dentro de la familia de las lacasa-ferroxidasas de oxidasas multicobre, que se correlaciona con la presencia o ausencia de algunos determinantes estructurales subyacentes a su posible actividad híbrida.
La superfamilia de las oxidasas multicobre (MCO) engloba una gran variedad de secuencias enzimáticas que comparten una arquitectura molecular común y la presencia de iones de cobre como cofactores para reducir el O2 a H2O, pero difieren en sus capacidades oxidantes y en su función fisiológica. La complejidad de la superfamilia MCO requiere estudios de estructura-función y filogenéticos para una mejor caracterización y clasificación de las diferentes familias MCO (lacasas, ferroxidasas, ascorbato oxidasas, etc.). En realidad, muchos nuevos genes de MCO emergentes se anotan erróneamente como lacasas, las MCOs más ampliamente utilizadas (en particular las secretadas por hongos basidiomicetos saprotróficos) debido a su capacidad para oxidar la lignina y una colección de compuestos aromáticos.
Las lacasa-ferroxidasas (LAC-FOX) son uno de los grupos de MCOs descritos, pero aún poco explorados, para los que se han propuesto actividades duales. Aza y colaboradores han realizado un análisis filogenético de todas las LAC-FOX de hongos basidiomicetos y han encontrado dos ramas evolutivas que se correlacionan con la presencia o ausencia de algunos de los tres residuos ácidos responsables de la actividad ferroxidasa en Fet3p de S. cerevisiae. Las enzimas del subgrupo 1 (con dos residuos ácidos análogos) muestran una actividad ferroxidasa eficiente y cierta actividad similar a la lacasa. Las enzimas del subgrupo 2 (con un solo residuo ácido) muestran una actividad ferroxidasa insuficiente o nula, pero una buena actividad lacasa.
Esto último se confirmó mediante la expresión heteróloga y la caracterización de la LAC-FOX de Heterobasidion annosum. La enzima recombinante oxida sustratos típicos de lacasa pero no tiene actividad ferroxidasa. De las variantes mutadas, sólo la que mantiene los tres residuos ácidos presenta una oxidación eficiente del Fe (II), mientras que conserva parcialmente la actividad oxidativa de la enzima nativa sobre compuestos aromáticos.
Estos resultados arrojan luz sobre los residuos catalíticos clave que impulsan las actividades ferroxidasa o lacasa en las enzimas MCO, al tiempo que abren nuevos escenarios para su aplicación.
Referencia: Multicopper oxidases with laccase-ferroxidase activity: Classification and study of ferroxidase activity determinants in a member from Heterobasidion annosum s. l. Pablo Aza, Gonzalo Molpeceres, Jesper Vind, Susana Camarero. Computational and Structural Biotechnology Journal 21 (2023) 1041–1053. https://doi.org/10.1016/j.csbj.2023.01.030

