Un trabajo publicado en la revista iScience por el grupo dirigido por el Dr. Miguel Peñalva en el Centro de Investigaciones Biológicas Margarita Salas (CSIC), en colaboración con el grupo del Dr. Ernesto Arias y el Servicio de Proteómica del mismo centro, presenta la identificación y caracterización de un complejo proteico que adapta la miosina V a las vesículas secretoras.
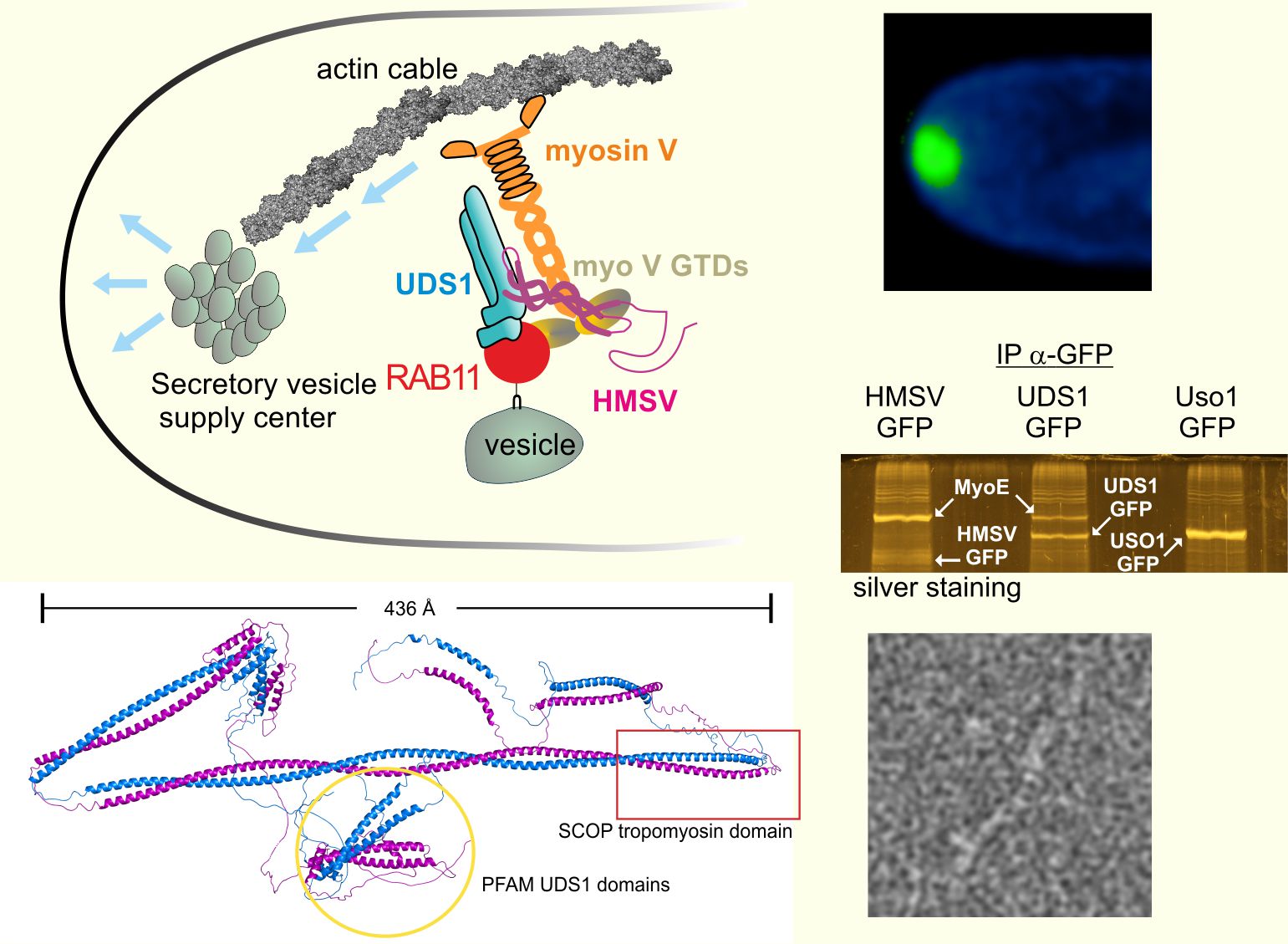
Las largas (> 100 mm) células tubulares de Aspergillus nidulans crecen por extensión apical, siendo ideales para investigar el transporte intracelular y la cooperación entre motores dependientes de microtúbulos y actina. Las vesículas secretoras son transportadas a las puntas por la kinesina-1, donde son transferidas a la miosina V, que las enfoca en un centro de suministro de vesículas situado bajo la membrana plasmática apical. Hasta el momento, el mecanismo por el que una sola miosina de tipo V reconoce la multiplicidad de cargos que se desplazan sobre los filamentos de actina no se comprende completamente.
Pinar et al. caracterizan el complejo proteico HUM, que adapta a la miosina V a estas vesículas secretoras. El complejo está constituido por la proteína RAB11 y dos proteínas accesorias, pendientes de caracterización, que ayudan a RAB11 a reclutar a la miosina V y se conocen como UDS1 y HMSV (hook of myosin to secretory vesicles). Estas dos proteínas, que muestran un alto contenido de coiled-coils y regiones no estructuradas, son firmes candidatas a desempeñar papeles estructurales en la estabilidad/ensamblaje del centro de suministro de vesículas, que podría representar un ejemplo más de orgánulo sin membrana.
Referencia: The type V myosin-containing complex HUM is a RAB11 effector powering movement of secretory vesicles. Mario Pinar, Ana Alonso, Vivian de los Ríos, Ignacio Bravo-Plaza, Álvaro de la Gándara, Antonio Galindo, Ernesto Arias-Palomo, Miguel Á. Peñalva (2022) Volume 25, Issue 7, 104514. https://doi.org/10.1016/j.isci.2022.104514

