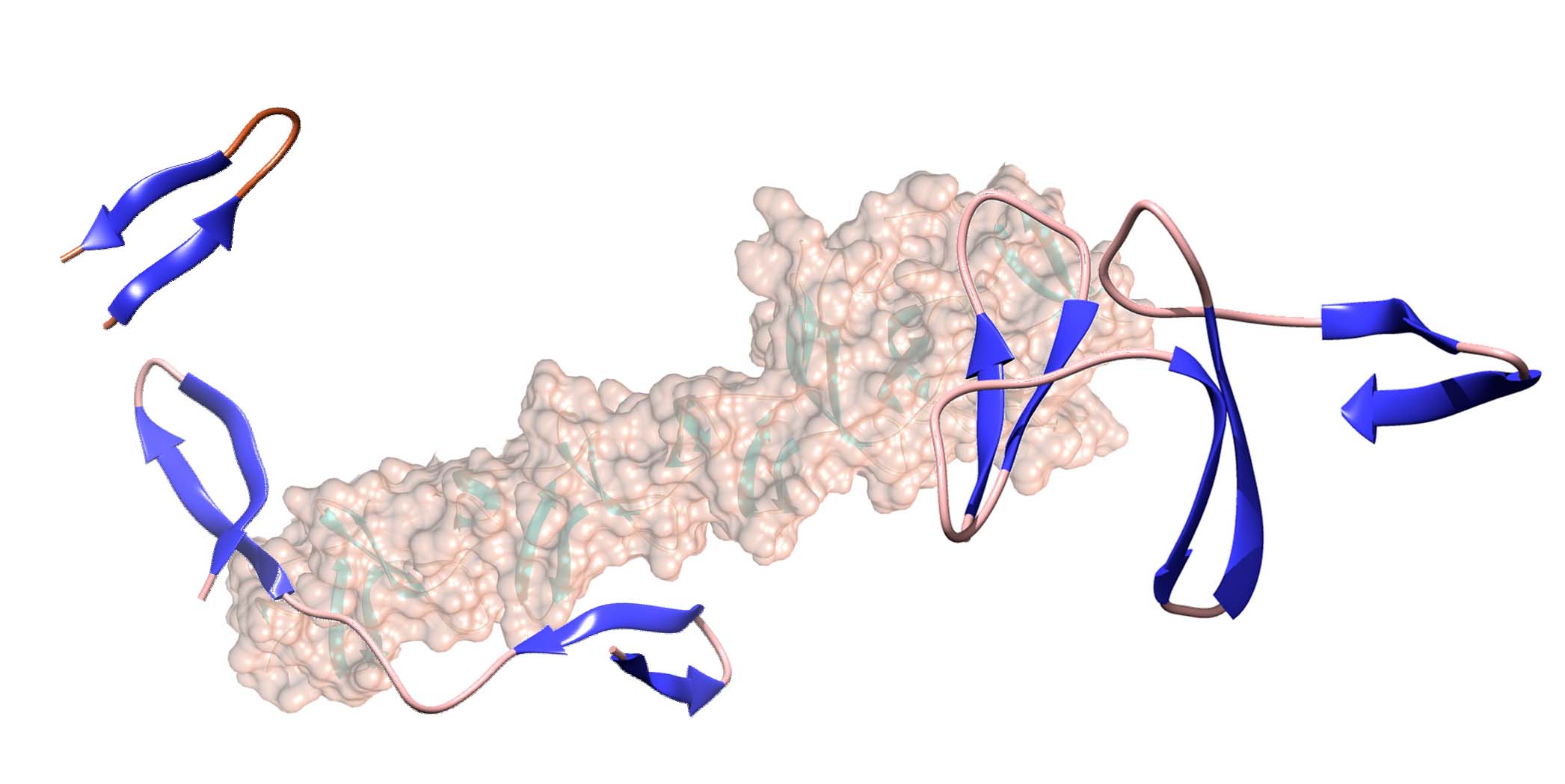
Un trabajo recientemente publicado en la revista International Journal of Biological Macromolecules por el grupo del Dr. Jesús Sanz en el Centro de Investigaciones Biológicas Margarita Salas (CIB-CSIC), en colaboración con el grupo de la Dra. Ma Ángeles Jiménez (Instituto de Química Física Rocasolano, CSIC), demuestra que se necesitan un mínimo de tres motivos repetidos para que un módulo de unión a colina adquiera la estructura nativa de tipo ββ-solenoide. Los investigadores del CSIC han identificado, además, que las secuencias enlazadoras entre las horquillas son los principales directores del plegamiento del solenoide.
La estructura estándar ββ-solenoide es un modo de plegamiento de proteínas que consiste en la repetición de horquillas β de 12 aminoácidos a lo largo de una superhélice de tres elementos por vuelta. Estas horquillas, a su vez, están unidas entre sí mediante conectores de 7-9 aminoácidos, en una suerte de escalera de caracol con tres peldaños por vuelta en la que estos conectores actuarían de pasamanos.
Trabajos previos de los autores demostraron que las horquillas β aisladas pueden adquirir la estructura nativa en disolución, independientemente del resto de la proteína, aunque quedaba por determinar qué haría falta para que dichas horquillas se reorganizaran entre sí para dar lugar a la superhélice.
Ahora, Maestro y cols. han realizado el estudio teórico, espectroscópico y termodinámico de una serie de péptidos que contienen entre una y tres horquillas con sus correspondientes conectores, y que constituyen las versiones mínimas del módulo de unión de colina ββ-solenoide de la autolisina LytA del patógeno Streptococcus pneumoniae (neumococo). Los resultados demuestran que la estructura empieza a formarse a partir de tres de dichos elementos y que las secuencias que los conectan son las que dirigen su plegamiento. Además, proporciona una explicación estructural a la existencia de las secuencias N- y C- terminales externas al ββ-solenoide pero que son esenciales para la estabilidad del mismo.
Los ββ-solenoides poseen sitios de unión de ligandos entre peldaño y peldaño, de manera que este plegamiento permite unir simultáneamente varias moléculas, que inducen la compactación de la estructura. Esta multivalencia los hace muy adecuados para unirse a sustratos poliméricos, lo que el laboratorio del Dr. Sanz ha empleado para el desarrollo de etiquetas de afinidad para la inmovilización y purificación de proteínas en kits ya comercializados
El estudio abre el camino para el diseño racional de otras estructuras de tipo ββ-solenoide con nuevas aplicaciones, mediante mutaciones en las secuencias conectoras, con vistas a crear un sistema de reconocimiento "a la carta" de estructuras poliméricas, por ejemplo, pertenecientes a la superficie de distintos microorganismos, con aplicaciones teranósticas relevantes.
En 2021 se cumplen los 20 años de la publicación de la primera estructura ββ-solenoide, el módulo C-LytA, que fue descrita por los investigadores del CIB Margarita Salas Carlos Fernández Tornero, Rubens López, Ernesto García, Guillermo Giménez y Antonio Romero, demostrando la tradición de este centro de investigación en el estudio de estas proteínas tan características.
Referencia: Inter-hairpin linker sequences determine the structure of the ββ-solenoid fold: a “bottom-up” study of pneumococcal LytA choline-binding module. Beatriz Maestro, Héctor Zamora-Carreras, Ángeles Jiménez, Jesús M. Sanz (2021) International Journal of Biological Macromolecules. 190, 679-692. https://doi.org/10.1016/j.ijbiomac.2021.08.223

