Tubulina es un interruptor molecular controlado por nucleótido. El GTP activa la proteína para favorecer la polimerización y la actividad GTPasa tiene lugar en el entramado microtubular, ya que el sitio de nucleótido sólo se completa al establecerse contactos axiales. La energía química derivada de la hidrólisis genera un estrés mecánico que promueve la despolimerización del microtúbulo en ausencia del CAP de GTP.
Los estudios estructurales son esenciales para entender las proteínas a nivel atómico y los mecanismos moleculares implicados en su funcionamiento. En el caso de tubulina, estas técnicas nos han permitido obtener fotogramas de los cambios conformacionales que tienen lugar en el ciclo de polimerización-despolimerización y los relativos al nucleótido unido. Entre los conocidos a día de hoy se encuentran el cambio curvo-recto que tiene lugar durante el ensamblaje (favorecido por la formación de contactos laterales) y el compacto-expandido que tiene lugar durante el ciclo GTPasa. Los moduladores de microtúbulos actúan impidiendo el cambio curvo-recto funcionando como cuñas (en el heterodímero o entre dos heterodímeros) o, el cambio recto-curvo mediante la estabilización del entramado microtubular. Algunos agentes desestabilizantes simplemente bloquean el extremo del microtúbulo impidiendo que continúe el ensamblaje.
Nosotros combinamos cristalografía de macromoléculas de tubulina curva (actualmente empleamos los complejos de tubulina-estadmina-tubulina tirosina ligasa y tubulina-darpina), con difracción de fibras de microtúbulos para comprender el efecto de nuevos productos naturales y compuestos sintetizados en la conformación de tubulina y la estructura de los microtúbulos. Estas técnicas requieren de radiación de sincrotrón y para ello tenemos acceso continuo a los sincrotrones ALBA y ESRF. Además, la microscopía electrónica y crio‑microscopía electrónica nos ayudan a caracterizar los polímeros formados por tubulina y, la técnica de RMN nos permite descifrar algunas características de la interacción de moduladores con tubulina y microtúbulos.
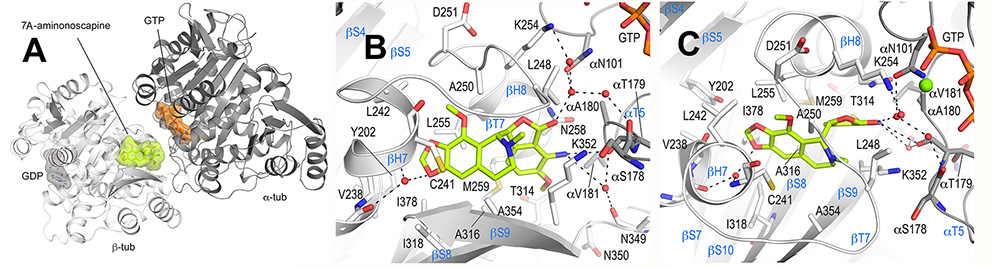
Figura- Estructura del complejo tubulina-7A-aminonoscapina. A. Representación de cintas de la estructura del complejo tubulina 7A-aminonoscapina (PDB ID 6Y6D). Las cadenas de α- y β-tubulina se representan en gris oscuro y claro respectivamente. El ligando 7A-aminonoscapina (verde claro) y los nucleótidos (naranja) se representan en barras y esferas respectivamente. Los átomos de carbono de los nucleótidos individuales están coloreados de acuerdo a sus respectivas cadenas peptídicas. Los átomos de oxígeno y nitrógeno están coloreados en rojo y azul respectivamente. B y C. Detalle de la red de interacción atómica observada entre 7A-aminonoscapina (verde claro) y tubulina (gris) en dos orientaciones diferentes. Los residuos de tubulina que interaccionan están representados en barras y están etiquetados. Los átomos de oxígeno y nitrógeno están coloreados en rojo y azul respectivamente, los enlaces de hidrógeno están representados como como lineas cortadas. Los elementos de estructura secundaria de la tubulina están marcados en azul, por simplicidad solo los residuos de α-tubulina están marcados como “α”.

