Un nuevo trabajo publicado en Nucleic Acids Research por el grupo del Prof. Julio Salinas en el Centro de Investigaciones Biológicas Margarita Salas ha demostrado que las prefoldinas, una familia de proteínas que ayudan a otras a plegarse, mantienen los niveles adecuados del complejo LSM2-8 en Arabidopsis, mediando la interacción entre la proteína LSM8 y la chaperona Hsp90, asegurando su estabilidad y la función adecuada del espliceosoma.
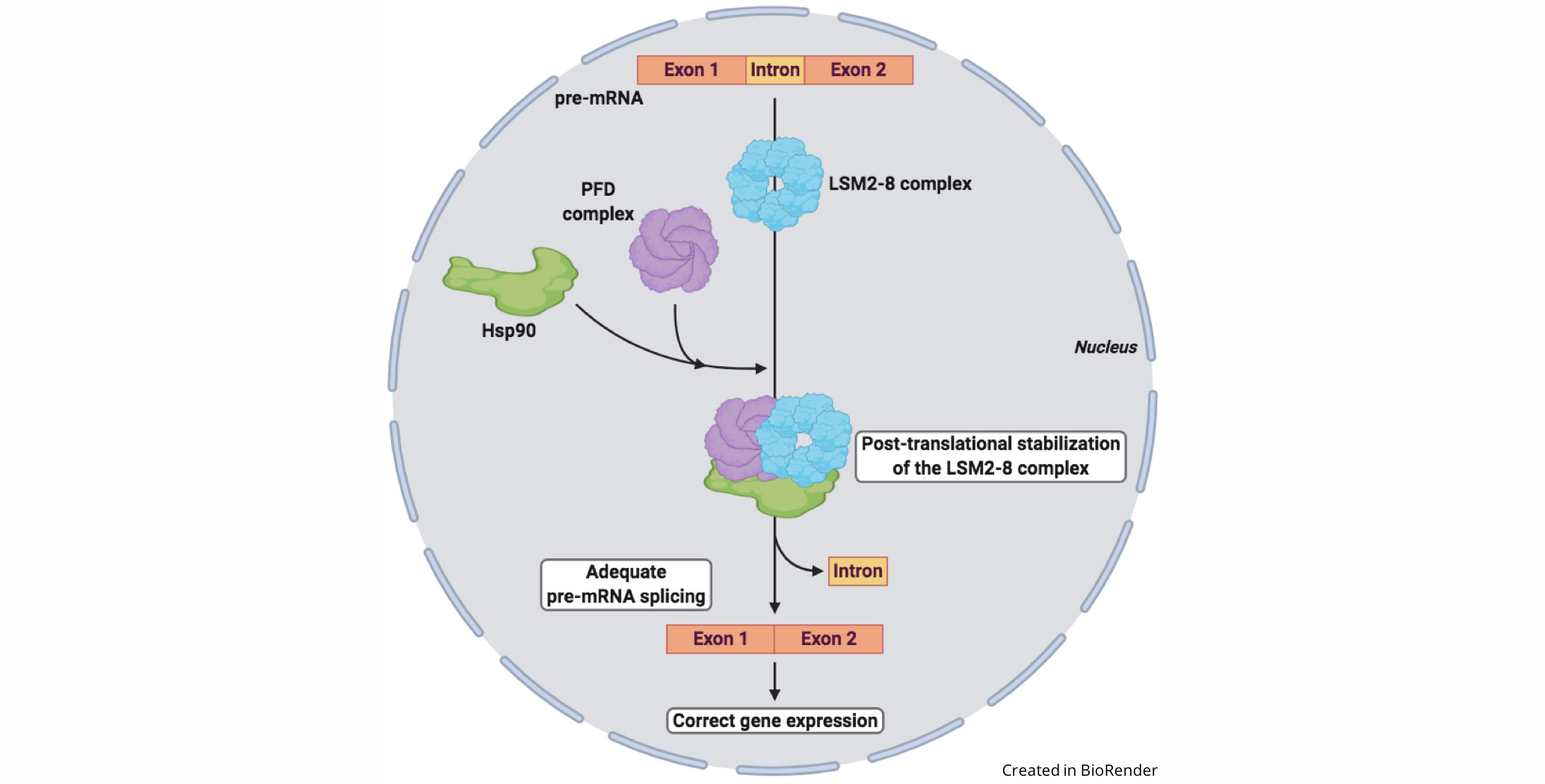
El splicing (corte y empalme) del pre-RNAm es un paso crucial en la expresión génica en eucariotas que realiza el espliceosoma, una gran maquinaria macromolecular constituida por cinco ribonucleoproteínas nucleares (snRNP), que constituyen su núcleo, y más de 200 proteínas asociadas. Cada snRNP, a su vez, está compuesto por un snRNA y sus correspondientes proteínas. Las proteínas de tipo Sm (LSM) forman un complejo heteroheptamérico, el LSM2-8, que interactúa específicamente con el snRNA U6, asegurando su estabilidad y niveles celulares. Teniendo en cuenta el papel de U6 en la reacción catalítica que tiene lugar en el splicing, la regulación de la estabilidad del complejo LSM2-8 es crítica para el funcionamiento adecuado del espliceosoma y una expresión génica correcta.
En este estudio, Esteve-Bruna et al. demuestran que la proteína LSM8, que define y confiere la especificidad funcional del complejo LSM2-8, interactúa con la chaperona Hsp90 en Arabidopsis, y que esta interacción asegura la estabilidad del complejo LSM2-8. Además, las evidencias genéticas y bioquímicas ponen de manifiesto que las prefoldinas (PFD), que forman un complejo hexamérico, median la interacción LSM8-Hsp90. De acuerdo con estos resultados y con el papel del complejo LSM2-8 en el splicing a través de la estabilización de U6, los mutantes pfd de Arabidopsis muestran niveles reducidos de este snRNA y patrones alterados del splicing de pre-mRNA.
En resumen, los resultados indican que se requiere la actividad de PFDs para mantener los niveles celulares del complejo LSM2-8, mediando la interacción de LSM8 con Hsp90. La acción de PFDs/Hsp90 representa un nuevo nivel de regulación postraduccional para el complejo LSM2-8 que, dada la elevada conservación evolutiva de las PFDs y los componentes del espliceosoma, también podría operar en otros eucariotas.
El trabajo, una colaboración con el Instituto de Biología Molecular y Celular de Plantas (CSIC-Universidad Politécnica de Valencia), la Fundación Instituto Leloir, el Instituto de Investigaciones Bioquímicas de Buenos Aires y la Universidad de Valencia, está co-dirigido por Julio Salinas y David Alabadi (IBMCP).
Referencia: Prefoldins contribute to maintaining the levels of the spliceosome LSM2–8 complex through Hsp90 in Arabidopsis. David Esteve-Bruna, Cristian Carrasco-López, Noel Blanco-Touriñán, Javier Iserte, Julián Calleja-Cabrera, Carlos Perea-Resa, Cristina Úrbez, Pedro Carrasco, Marcelo J. Yanovsky, Miguel A. Blázquez, Julio Salinas, and David Alabad (2020) Nucleic Acids Research. doi: 10.1093/nar/gkaa354

