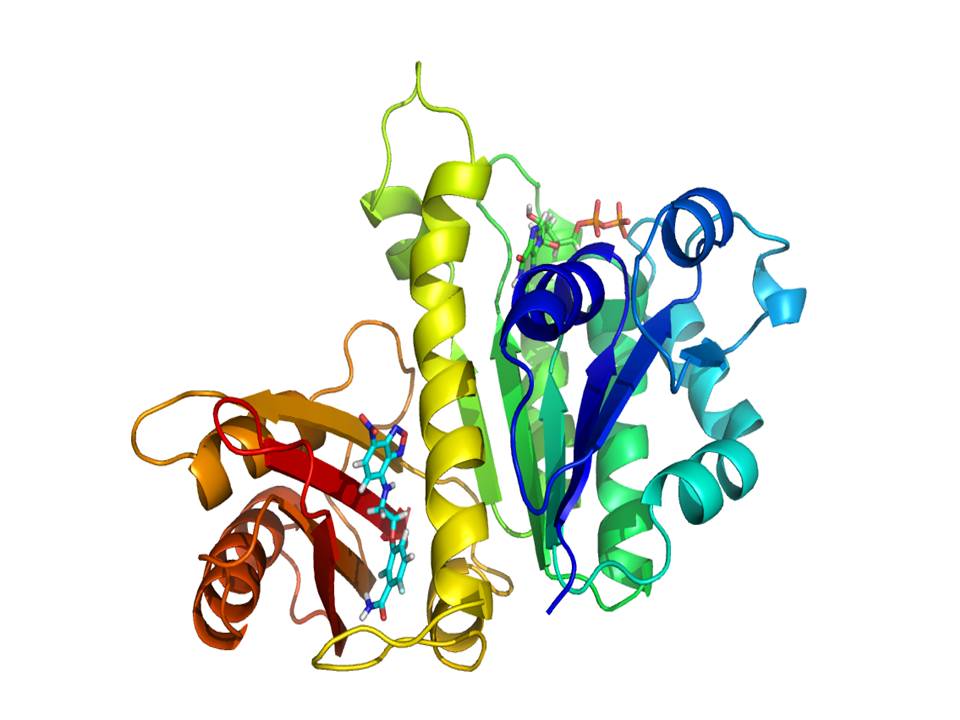
FtsZ es una GTPasa altamente conservada, estructuralmente similar a la tubulina, que dirige la división celular en la mayoría de las bacterias y es una diana para el descubrimiento de nuevos antibióticos necesarios para contrarrestar la expansión de bacterias patógenas resistentes. Esta fascinante máquina de ensamblaje macromolecular funciona polimerizando de manera cooperativa en filamentos monocatenarios, mediante isomerización del monómero entre conformaciones inactiva y activa para autoasociar. Las comparaciones estructurales entre diferentes FtsZ sugerían un mecanismo de interruptor molecular que consiste en un movimiento de apertura de una hendidura entre los dominios C y N-terminales de FtsZ, acoplado alostéricamente a la formación de una interfaz de asociación fuerte entre subunidades consecutivas a lo largo del filamento.Un reciente trabajo publicado en la revista de la Royal Society of Chemistry Chemical Science (DOI: 10.1039/C6SC03792E) y realizado en colaboración de los laboratorios de "Tubulinas y FtsZ" del CIB, dirigido por José Manuel Andreu, de Química Médica de la UCM y el grupo de Bioinformática Estructural del Instituto de Química Física Rocasolano del CSIC, muestra al interruptor de FtsZ en acción: la hendidura entre los dos dominios está abierta en las subunidades ensambladas y permanece cerrada en los monómeros no ensamblados en la solución. Para estos estudios se han sintetizado análogos fluorescentes del inhibidor antibacteriano PC190723, cuya anisotropía de fluorescencia se incrementa al unirse específicamente en la hendidura abierta de los polímeros de FtsZ de Staphylococcus aureus. Estas sondas además marcan de manera directa FtsZ en anillos de división en células bacterianas. Este trabajo abre las puertas a ensayos competitivos de fluorescencia que combinados con métodos de perfilado citológico pueden emplearse para cribar inhibidores alostéricos del ensamblaje de FtsZ en la búsqueda de antibióticos con nuevos mecanismos de acción.

