Un estudio internacional con participación del investigador Guillermo Giménez Gallego y el Grupo de RMN del Centro de Investigaciones Biológicas (CSIC), acaba de ser publicado en la revista Cell Reports (Zirafi et al., 2015, Cell Reports 11, 737747 doi:10.1016/j.celrep.2015.03.061).
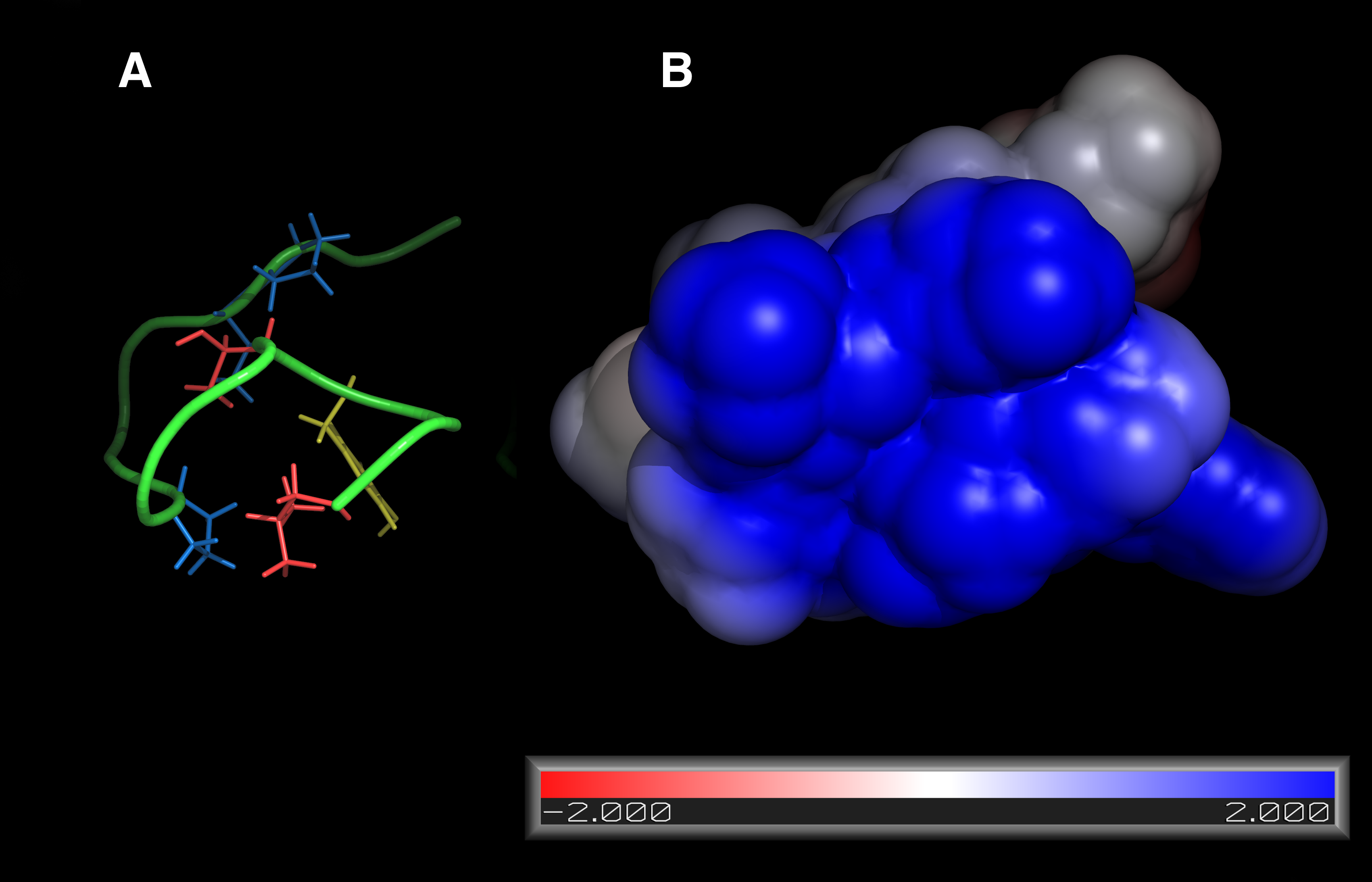
El estudio incluye el descubrimiento y la determinación de la estructura atómica, por Resonancia Magnética Nuclear, de la proteína EPI-X4. Esta proteína impide que la citoquina CXCL12 interaccione con la proteína CXCR4, su receptor en la membrana celular. La estructura atómica de EPI‑X4 ha permitido diseñar análogos unas cien veces más potentes que pueden servir como agentes terapéuticos para tratar enfermedades muy importantes, pues los elevados niveles de CXCL12 están asociados a inflamaciones difícilmente tratables y a la metástasis tumoral. Por otra parte, EPI-X4 y los análogos descritos en el artículo inhiben la infectividad del virus X4VIH-1, la variedad que predomina en los enfermos del SIDA desde el momento que empiezan a dar síntomas de la enfermedad, pues éste necesita unirse a CXCR4 para invadir la célula. EPI‑X4 es, además, abundante en la orina de pacientes con enfermedades inflamatorias de riñón, lo que podría permitir su uso como marcador para diagnosticar estas enfermedades.
La estructura atómica de EPI‑X4 adopta una disposición de tipo anillo con una “cola”. El anillo tiene una cara fuertemente hidrofóbica y otra con alta densidad de cargas positivas, apta para interaccionar fuertemente con la región extracelular de CXCR4, que es extraordinariamente abundante en cargas negativas.

