La degradación del ARN mensajero mediada por mutaciones terminadoras (Nonsense-mediated mRNA decay " NMD) es un mecanismo de control usado por las células para eliminar ARNm aberrantes que se originan por mutaciones en la línea germinal en muchos desórdenes genéticos, así como los originados por errores durante la transcripción. Recientemente, se ha descubierto que el sistema NMD juega un papel más general en la regulación de la expresión génica controlando la degradación de un subconjunto de ARNm y tiene un papel crucial en la diferenciación de células madre. A pesar de su relevancia, el mecanismo molecular detallado de este proceso no se conoce completamente todavía.
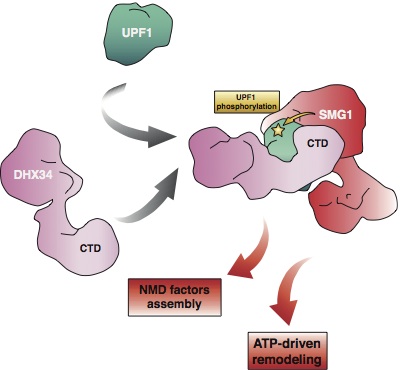
La decisión de degradar o no un ARNm mediante el sistema NMD es tomada por un conjunto de factores proteicos, principalmente las proteínas UPF1, UPF2 y UPF3. Este proceso se desencadena únicamente cuando UPF1 es fosforilada por una quinasa específica, la SMG1 en concreto. Algunas de las preguntas que estaban por responder en este campo eran cómo los factores NMD se organizaban en torno al ARNm y cómo se regulaba la fosforilación de UPF1.
En dos artículos recientemente publicados, el grupo de Óscar Llorca, investigador del departamento de Biología Físico-Química del CIB, contribuye a mejorar el entendimiento de esta ruta de degradación de ARNm.
Lopez-Perrote et al. muestran en la revista Nucleic Acids Research un mecanismo por el que UPF2 puede unirse específicamente al ribosoma interaccionando con el factor de liberación eucariota, eRF3.
Melero et al., por otro lado, revelan en Nature Comm. alguna de las bases moleculares y estructurales de la regulación de la fosforilación de UPF1, mostrando que la helicasa DHX34 recientemente descubierta funciona como plataforma para la interacción del sustrato (UPF1) y la quinasa (SMG1) para promover la fosforilación de UPF1 por SMG1.

